سنتز آسپرین
عنوان آزمایش: سنتز آسپرین
هدف آزمایش : آشنایی با روش ساخت آسپرین
وسایل لازم: حمام بن ماری، بشر، دماسنج جیوه ای، قیف، کاغذ صافی، پیپت و پیست
مواد لازم: سالسیلیک اسید، انیدرید استیک و سولفوریک اسید
تئوری:بيشتر استرها مايع و يا بلورين بوده و بوي مطبوع دارند . واکنش عمده ي استرها عبارتند از صابوني شدن (وارون استري شدن) , تشکيل اسيد آميد (آمونوليز) هيدروژن دار شدن (کاهش بووبلان) , توليد الکلهاي نوع سوم (واکنش گرينيارد) و تبديا استري (الکوليز). بهترين روشها براي تهيه ي استرها عبارتند از :
1- روش معمول براي تهيه ي استر , ترکيب اسد و الکل مي باشد , مثل ترکيب استيک اسيد با اتانول که توليد اتيل استات و آب مي کند .
2- از ترکيب نمک هاي کربوکسيلي اسيد به ويژه نمک هاي نقره با الکيل يديد , استر به دست مي آيد.
3- از ترکيب انيدريدها با الکلها , استر توليد ميشود . اين واکنش بهره خوبي داشته و سرعت آن توسط پيريدين افزايش ميابد .
|
|
4- روش ويژه براي تهيه استرهاي متيل , واکنش اسيدها با ديازومتان در محلول اتري ميباشد .
کاربرد استرها :
چربي ها , مومها و روغنها از اهميت ويژه اي برخوردارند . استر ها به عنوان حلال کاربرد وسيعي داشته و از استر هاي فسفريک اسيد به عنوان حشره کش و سلاح شيميايي استافاده ميشود . از استر هاي نيترو اسيد براي تسريع اشتعال در موتورهاي ديزلي و نيز در پزشکي براي مداراي آهژين (ايزو آمين نيتريک) بهره ميگيرند . استرهاي نيتريک اسيد , به ويژه گليسيرين تري نيترات , اغلب به عنوان ماده منفجره کاربرد دارند .
آسپيرين :
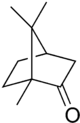
جسمي با فرمول شيميايي : که آن را استيل ساليسيليک اسي نيز گويند . آسپيرين به صورت قرص براي تسکين درد و کاهش تب , به کار ميرود .
داستان کشف آسپرین:
Felix Hoffmann
سازنده اولین قرص آسپرین
فردریک بایر (Fredrich Bayer) در سال 1825 بدنیا آمد. پدر او یک نساج و رنگرز پارچه بود و طبق عادت آن زمان وی در ابتدا شغل و حرفه پدر را برای کار انتخاب کرد و پس از مدتی فعالیت با پدر، در سال 1848 تشکیلاتی مشابه برای خود راه اندازی کرد و در آن حرفه بسیار هم موفق شد.
تا قبل از 1856 برای رنگرزی از مواد رنگی طبیعی استفاده می شد اما با کشف و صنعتی شدن ساخت رنگهای حاصل از مواد نفتی، بایر که پتانسیل موجود در این کشف را بخوبی احساس کرده بود با کمک شخصی بنام فردریک وسکوت (Friedrich Weskott) کمپانی Bayer را راه اندازی کرد.
بایر در ماه می سال 1880 در گذشت و تا آن زمان کمپانی هنوز در فعالیت رنگرزی مشغول بود، اما شرکت تصمیم گرفت با استخدام تعدادی شیمیدان نوآوری هایی در این صنعت بوجود آورد و این اتفاق هم افتاد اما نه در صنعت رنگرزی.
هنگامی که فلیکس هوفمن (Felix Hoffmann) در حال انجام آزمایش با یکسری از ضایعات رنگی بود تا شاید بتواند دارویی برای درمان درد ناشی از بیماری پدرش بدست آورد توانست به پودری دسترسی پیدا کند که امروزه شما آنرا به نام آسپرین می شناسید.
هوفمن آسپرین را کشف نکرد
تعجب نکنید! هوفمن آسپرین را دوباره کشف کرد. آسپرین چهل سال قبل توسط یک شیمیدان فرانسوی کشف شده بود، این شیمیدان بخوبی می دانست که پودر اسید استیل-سالی-سیلیک (acetylsalicylic acid) دارای خاصیت شفا بخشی بسیار می باشد. در واقع بیش از 3500 سال بود که بشر این پودر را می شناخت چرا که در سال 1800 یک باستان شناس آلمانی که در مصر تحقیق می کرد، با ترجمه یکی از پاپیروس های مصری متوجه شد که بیش از 877 نوع مواد دارویی برای مصارف مختلف در مصر باستان شناخته شده بود که یکی از آنها همین پودر اسید بود که برای برطرف کردن درد از آن استفاده می شد.
Fredrich Bayer ، موسس شرکت بایر
در برخی از شواهد و نوشته های دیگری که در یونان بدست آمده است نیز مشخص شده که بشر حدود 400 سال پیش از میلاد از شیره پوست درخت بید برای درمان تب و درد استفاده می کرده است. همچنین آنها هنگام زایمان زنان از این ماده برای کاهش درد استفاده می کردند. امروزه مشخص شده که ماده موجود در این شیره چیزی جز اسید سالی-سیلیک نیست.
ثبت رسمی کشف آسپرین
در ماه مارچ 1899 کمپانی بایر رسما" محصول خود بنام آسپرین را به ثبت رساند و به دنبال آن در سایر کشورهای جهان نیز تحقیقاتی گسترده راجع به این دارو انجام گرفت بگونه ای که هنگام بازنشستگی هوفمن در سال 1928، آسپرین در تمام دنیا شناخته شده بود.
آسپرین از مهمترین اکتشافات هوفمن بود اما این تنها کشف او نبود. درست چند روز پس از کشف آسپرین هوفمن به ماده ای دست پیدا کرد که امروز در بازار بنام هروئین (Heroin) مشهور شده است. از این ماده مخدر در تمام مدت جنگ جنگ جهانی اول بعنوان یک دارو استفاده می شد اما امروزه در تمام کشور های جهان از فهرست دارو ها خط خورده است.
شرح کار:
مقدار 2 گرم سالسیلیک اسید را در 3 میلی لیتر انیدرید استیک حل نموده و 2 قطره اسید سولفوریک به عنوان کاتالیزور به آن اظاف می کنیم، مخلوط را با یک هم زن کمی به هم زده و به مدت 15 الی 20 دقیقه روی یک بن ماری در درجه حرارت 50 الی 60 درجه سانتی گراد حرارت می دهیم. سپس کمی اجازه می دهیم تا مخلوط خنک شود و به آن 20 میلی لیتر آب مقطر اظافه می کنیم و رسوبات را صاف می نماییم.

موارد خطا:
چنانچه دمای بن ماری از از 60درجه سانتی گراد بالاتر رود آسپرین تجزیه می شود.
نتیجه گیری:
با توجه به اینکه واکنش انجام گرفته از نوع جانشینی نکلئوفیلی می باشد و نکلئوفیل از طریق زوج الکترون اتم اکسیژن گروه الکلی سالسیلیک اسید به کربن گروه کربونیل گروه انیدرید استیک حمله می کند و به دلیل خنثی بودن ( نکلئوفیل آنیون نمی باشد) قدرت آن نسبتاً کم است از اسید سولفوریک به عنوان کاتالیزور استفاده می شود تا باعث فعال شدن مکانی گردد که نکلئوفیل می خواهد به آنجا حمله کند و نهایتاً در ملکول آسپزین یک پیوند استری تشکیل می شود.
منابع:دنیای گزارش کار شیمی
تخمير
تخمير پدیدهای است ناشی از مجموعه فعالیتهای زیستی که در آن ترکیبات آلی دارای مولکولهای بزرگ به ترکیبات دارای مولکولهای کوچکتر و سادهتر شکسته و تجزیه (کاتابولیسم) شده از فرآیند آن علاوه بر ایجاد ترکیبات آلی سادهتر، دیاکسیدکربن و انرژی نیز آزاد میگردد. با بیان دیگر تخمیر تجزیه ناقص بعضی از متابولیتها (ترکیبات آلی) به ترکیبات سادهتر همراه با انرژی توسط عامل تخمیری است.
نگاه کلی
در گیاهان تخمیر بیولوژیکی تنها تخمیر الکلی نبوده، ممکن است با کمی تخمیر لاکتیک نیز همراه باشد، برخی از سازوارههای حیاتی (میکروارگانیسمها) مانند قارچهای میکروسکوپی نیز قادر به تخمیرهایی مانند تخمیرهای سیتریک و اکسالیک روی قندهای شش کربنی (هگزوزها) و تخمیر استیک روی الکل اتیلیک و غیره هستند. باکتریها عامل انواع دیگری از تخمیر در طبیعت هستند. تخمیر بوتیریک سلولز لاشه برگها و تجزیه آنها که سبب افزایش ترکیبات آلی خاک میشود و همچنین تخمیرهای تعفنی مواد آلی توسط باکتریها صورت میگیرد.
واژگان شيمي فزيك
| معادل فارسی | تعریف | واژه لاتین |
| آنتالپی | محتوی گرمایی یک نمونه از ماده | enthalpy |
| آنتالپی تشکیل | برای یک ماده مرکب معین ، تغییر آنتالپی واکنشی که در آن ، یک مول ماده مرکب از پایدارترین شکلهای عناصر آن تشکیل می شود، آنتالپی تشکیل مینامند. | enthalpy of formation |
| قانون هس یا قانون جمعبندی ثابت گرما | تغییر آنتالپی واکنش شیمیایی ، ثابت است، خواه واکنش در یک مرحله ، خواه در دو مرحله انجام گیرد. | Hess,s law |
واژگان شيمي تجزيه
| معادل فارسی | تعریف | واژه لاتین |
| اسید سیستم حلالی | ماده ای که کاتیون حلال را میدهد. | salvent-system acid |
| باز سیستم حلالی | ماده ای که آنیون حلال را میدهد | solvent-system base |
| ماده آمفی پروتیک | ماده ای که میتواند به صورت یک اسید برونشتد عمل کند. | amphiprotic substance |
تعادل شيميايي
تعادل شيميايي
تمام فرآیندهای برگشت پذیر ، تمایل به رسیدن به یک حالت تعادلی دارند. برای یک واکنش برگشت پذیر ، حالت تعادل وقتی برقرار میشود که سرعت واکنش رفت برابر با سرعت واکنش برگشت باشد. پیکان دوگانه در حد وسط یک واکنش و معادله شیمیایی ، نشانگر این است که میتوانیم هم در جهت رفت و هم در جهت برگشت معادله را بخوانیم.
واکنشهای برگشت پذیر و تعادل شیمیایی واکنش فرضی زیر را در نظر میگیریم:
(A2(g)+B2(g)↔2AB(g
این معادله را میتوانیم هم در جهت رفت و ....
تعادل شيميايي
تعادل شيميايي
تمام فرآیندهای برگشت پذیر ، تمایل به رسیدن به یک حالت تعادلی دارند. برای یک واکنش برگشت پذیر ، حالت تعادل وقتی برقرار میشود که سرعت واکنش رفت برابر با سرعت واکنش برگشت باشد. پیکان دوگانه در حد وسط یک واکنش و معادله شیمیایی ، نشانگر این است که میتوانیم هم در جهت رفت و هم در جهت برگشت معادله را بخوانیم.
واکنشهای برگشت پذیر و تعادل شیمیایی واکنش فرضی زیر را در نظر میگیریم:
(A2(g)+B2(g)↔2AB(g
این معادله را میتوانیم هم در جهت رفت و ....
همگرايي زيست فناوري و فناورينانو
| ||
| نويسنده : - | ||
| مترجم :علي عباسي | ||
| كليد واژه ها :نانوبيو , همگرايي | ||
خلاصه
| ||
گوجه فرنگی به عنوان باتری ساعت
دفترچه کنکور کارشناسی ارشد شیمی

منابع و نحوه خواندن برای کنکور ارشد شیمی
کنکور کارشناسی ارشد شیمی در هفت گرایش برگزار میشود که دارای ضرایب متفاوت درسی هستند . اینکه ما در کدام گرایشها علاقمند به ادامه تحصیل هستیم نقش تعیین کننده ای در نوع درس خواندنمان دارد . در دفترچه های ثبت نام کنکور این ضرایب درج شده است .

جدول تناوبی عنصرها
اندازه گیری ضریب چسبندگی مایعات(ویسکوزیته)
اندازه گیری ضریب چسبندگی مایعات(ویسکوزیته)
تئوری آزمایش :
مایع ، درون یک ظرف ، شکل ظرف را به خود میگیرد. این توانایی حرکت یا جریان یافتن یکی از ویژگیهای بسیار مهم مایعات است. وسیکوزیته ( گرانروی ) ، اندازه مقاومت مایعات در برابر جریان یافتن است. در این آزمایش ، با استفاده از گرانروی مایعات خانگی، یک وسیکومتر خواهیم ساخت. وسیکومتر ، وسیله ای است که سرعت جریان مایعات را اندازهگیری میکند. با استفاده از سرعت جریان ، شاخص گرانروی را اندازه میگیریم که از نسبت گرانروی مایع مورد نظر به گرانروی آب بدست میآید.
هدف آزمایش :
مواد لازم :
روش کار :
نتایج :
نظريه جنبشي مولكولي گازها
دز این قسمت برای شما یک فایل پاور پوینت از شیمی فیزیک
قرار دادیم که می توانید آن را دانلود کنید
کافور
کافور یک ماده ی چسب ناک سفید؛ یا جامد شفاف معطر و یک ترپنویید با فرمول شیمیایی C10H16O است. کافور از چوب درخت همیشه سبز Camphor laurel و در بعضی دیگر از درختان خانواده ی Laurel و بویژه در درخت بدست می آید. این ماده می تواند به طور مصنوعی از روغن ترپانتین تولید شود. کافور به علت دارا بودن بوی خوش کاربرد فراوانی دارد و از آن به عنوان عنصری در غذا( بویژه در هند) ، مایع حنوط کننده، در جشن های مذهبی و برای اهداف پژشکی و دارویی استفاده می شود.
موارد استفاده:
کافور در پخت و پز و آشپزی:
سم شناسی:
واکنش ها:
اتم
این کلمه ، از کلمه یونانی atomos ، غیر قابل تقسیم ، که از a- ، بمعنی غیر و tomos، بمعنی برش ، ساخته شده است. معمولا به معنای اتمهای شیمیایی یعنی اساسیترین اجزاء مولکولها و مواد ساده میباشد.
تاریخچه شناسایی اتم
مواد متنوعی که روزانه در آزمایش و تجربه با آن روبه رو هستیم، متشکل از اتمهای گسسته است. وجود چنین ذراتی برای اولین بار توسط فیلسوفان یونانی مانند دموکریتوس (Democritus) ، لئوسیپوس (Leucippus) و اپیکورینز (Epicureanism) ولی ...
اندازه اتم
ذرات درونی اتم
طبقهبندی اتمها
سادهترین اتم
واکنش شیمیایی اتمها
ساخت صابون وساختار
صابون ها، نمک سدیم یا پتاسیم اسیدهای چرب هستند که از هیدرولیز (تجزیه در اثر حضور آب) اسیدهای چرب (چربیها و روغن ها) در محیط قلیایی به دست میآیند. هر مولکول صابون از یک زنجیر هیدروکربنی بلند یا "دم" و یک کربوکسیلات یا "سر" تشکیل شده است. وقتی صابون در آب حل شود، یون سدیم یا پتاسیم از سر آن جدا میشود و سر مولکول بار منفی پیدا میکند.
|
|
صابون تمیز میکند، چون یک امولسیفایر (Emulsifier) خوب است. امولسیفایر به ماده ای گفته میشود که باعث میشود ذرات یک مایع در یک مایع غیر قابل امتزاج با آن پخش شوند و یک امولسیون پایدار تشکیل گردد.
چربی و روغن روی پوست (که چرک و کثیفی را به خود میگیرد).
در شرایط عادی با آب مخلوط نمی شود، اما صابون کاری میکند که چربیها در آب حل شده و شسته شوند.
بخش آلی مولکول صابون طبیعی، یک مولکول قطبی با بار منفی است. گروه کربوکسیلات
(CO-2-) انتهای آن آب دوست (Hydrophilic) است و از طریق پیوندهای یون - دو قطبی و هیدروژنی با مولکول های آب پیوند برقرار میکند. زنجیر هیروکربنی بلند موجود در مولکول، غیر قطبی است. پس با مولکولهای آب کاری ندارد (آب گریز، Hydrophobic). این زنجیرها از طریق نیروهای لاندن جذب همدیگر میشود و گویچه هایی مانند شکل زیر را پدید میآورند که اصطلاحا مایسل (micelle) نامیده میشود. هر مایسل، کره کوچکی است که از زنجیرهای هیدروکربنی تشکیل شده است و سطح آن را گروههای کربوکسیلات که بار منفی دارند، پوشانده اند. این بارهای منفی باعث میشود که مایسلها همدیگر را دفع کنند و در آب معلق بمانند.
|
|
مولکولهای چربی و روغن غیر قطبی اند و در آب حل نمی شوند؛ به همین دلیل به بخش هیدروکربنی صابون متصل میشوند. یعنی در مرکز هر مایسل یک ذره چربی قرار دارد، که وقتی دست خود را با آب میشویید، همراه با آب از روی پوست پاک میشود.
مباحث تقارن،گروه های نقطه ای،جدول های کاراکتر و ...
Symmetry in Chemistry
جزوه ای کامل و فوق العاده در مورد تقارن شامل مباحث تقارن،گروه های نقطه ای،جدول های کاراکتر و ... همراه با آموزش صوتی.
مقدمه ای بر شیمی فضایی
پاور پوینت های شیمی فضایی
شیمی فضایی و مفاهیمی چون کایرالیتی و انانتیومر ها و دیاستومر ها یکی از قسمت های مشکل شیمی آلی است . به این دلیل که برای یادگیری این مباحث باید از قدرت تجسم بالایی برخوردار بود . فایل های پاور پوینت زیر به شما در درک و تجسم این بخش ها کمک فراوانی خواهند کرد . همچنین شما می توانید در صورت برخورد با مشکل سوالتان را در قسمت نظرات مطرح نمایید .
Stereochemistry & Chiral Molecules
Organic Chemistry & Stereochemistry
Stereochemistry: Chiral Molecules
Stereochemistry (Organic Chemistry)1
Stereochemistry Considerations
آسپرین
آسپرین یکی از پر طرفدارترین دارو ها در دنیاست . هر سال ۵۰۰۰۰ میلیون قرص آسپرین در جهان مصرف میشود. در بریتانیا هر فرد سالانه ۷۰ قرص آن را جدا یا همراه با مسکنهای دیگر ، کافیین یا ویتامین “ث” مصرف میکند . آسپرین علاوه بر خاصیت تسکین دهندگی ، تب بر و ضد التهاب هم هست ، ضمن اینکه اثرهایی نظیر ایجاد زخمهای گوارشی و جلوگیری از لخته شدن خون را نیز از خود نشان میدهد .
آسپرين
مسکن ها قادرند درد را در منبع يا در مکاني بالاتر، در مسير ادراکي، در دستگاه اعصاب مرکزي متوقف کنند.در حالي که مسکن ها که بر دستگاه اعصاب مرکزي عمل ميکنند داراي عوامل بسيار قدرتمند مانند : "مورفين" هستند اکثرا مسکن هاي معمولي بر اندام هاي پيراموني دستگاه عصبي عمل کرده و به عنوان داروهاي ضدالتهاب غير استروبيدي NSAIDS رده بندي ميشوند.

اين گروه شامل استيل ساليسيليک اسيد (SAS) که اولين بار در 1897 توسط فکيلس هونمان توليد شد و دو سال بعد "آسپرين" نام گرفت و برخي دستاورد هاي جديد مانند: "ايبو پروفين" و "پاراستامول" است. اين دارو ها زيست سنتز پروستاگلاندين ها يعني گروهي از هورمون ها ي موضعي درگير در فرآيندهاي مختلف از جمله التهاب را هدف قرار ميدهند. آسپرين با جلوگيري از دو گونه آنزيم سيکلواکسيژناز نه تنها از سنتز پروستاگلاندين ها بلکه از ترمبوکسانهاي لخته کننده خون نيز جلوگيري ميکنند . بنابراين آسپرين اثر ها و عوارض جانبي فراوان دارد که برخي مطلوب مانند:جلوگيري از لخته شدن خون، پيشگيري از حمله هلي قلبي و جلوگيري از بروز برخي سرطان ها و برخي نامطلوب مانند: صدمه معده و کليه ها است
انواع صابون از نظر نوع مصرف :
1)صابون حمام و دستشويي (صابون سخت ) : در اين نوع صابون ها براي رعايت نکات بهداشتي مربوط به پوست بدن و موي سر مواد قليايي را به حداقل کاهش داده مواد پرکننده ي طبيعي و خنثي مواد معطر رنگي و نرم کننده ي پوست نيز به آنها اضافه مي شود.
2 )صابون رخت شويي : اين نوع صابونها از مواد چربق ارزان تهيه مي شود. اما امروزه به علت استفاده از پاک کننده هاي غير صابوني مصرف آنها کاهش يافته است. نو.عي صابون سياه رنگ که از پتاس در آن استفاده مي شود نيز براي شستن لباس تهيه مي شود. صابون رختشويي ممکن است به صورت براده پودر (حتي مخلوط با پودر پاک کننده هاي غير صابوني ) براي مصرف در لباسشويي استفاده مي شود.
ارلن مایر
ارلن (يا ارلن ماير) یک ظرف مخروطی با گردن نسبتا باریک در حجمهای مختلف است و قسمت بالاي آن باريكتر و اندكي برگشته و قيفي شكل است، بدينوسيله هم مي توان از ريختن مايع به بيرون جلوگيري كرد و هم مي توان مايع را به داخل آن آسانتر ريخت.
ارلن ممكن است ساده يا مدرج باشد. از نوع مدرج آن براي برداشتن حجم معيني از مايع يا تعيين تقريبي حجم مايع استفاده مي شود اما نوع ساده آن براي استفاده از كارهاي گوناگون مانند گرم كردن مايعات، مخلوط کردن و حتی نگه داری مایعات و یا به عنوان جمع کننده محصول تقطیر در عمل تقطیر و یا جمع کننده مایع خارج شده از قیف جدا کننده در هنگام عمل استخراج نیز استفاده میشود.

کشف عنصر ۱۱۸
پس از فروکش کردن تب کشف اين عنصر در سال 2002 ، تيمي جديد مرکب از محققان مدعي شده که موفق به توليد تعدادي از سنگين ترين عنصرها شده و پس از شمردن تعداد پروتون هاي هسته ، آن را عنصر 118 نامگذاري کرده اند.
اين کشف در نتيجه ماهها بمباران يک هدف راديواکتيو توسط اتمهاي سنگين و سپس جستجو براي رشته اي مشخص از نيمه عمرهاي راديو اکتيو به دست آمده است.
به هرحال گزارش موقعي تاييد شد که گروه ديگري نيز اين نتيجه را به دست آورده بود. در شيمي هر عنصر داراي تعدادي ثابت از الکترون ها ، نوترون ها و پروتون ها هستند.
محققان معتقدند که دسته اي ديگر از عناصر وجود دارند که داراي تعداد نسبتا ثابتي از ذرات سنگين فوق يعني پروتون ها هستند.
آزمايش هاي انجام شده در مرکز تحقيقات مشترک واقع در روسيه تعداد عناصر ثبت شده را قبلا از 113 به 116 رسانيده است.
اين گروه هدف قرار دادن کاليفرنيم 249 را توسط يونهاي کلسيم 48 آغاز کرده و اين تصامات منجر به ترکيب اين دو عنصر شده و حاصل عنصري با 118 پروتون و 143 نوترون مي شود. اين عنصر در جدول تناوبي دقيقا زير رادون قرار خواهد گرفت.
پس از تشکيل عنصر 118 در فرآيند آزمايش ، اين عنصر متلاشي شده و به عنصر 116 و عناصر سبک تر تجزيه مي شود. اين پروسه با آزاد سازي تشعشعات آلفا همراه است که هر کدام دو پروتون دارند.
يکي از اعضاي اين تيم مي گويد نزديک شدن به اين تعداد پروتون در دماي بالايي که توسط اين بمباران صورت مي گيرد ، کاملا ثابت و پايدار نيست و گروه بايد در ميان حوادث اتفاق افتاده به جستجو بپردازد.
سرانجام بعد از 4 ماه آزمايش انجام شده در 2002 و 2005 محققان متوجه سه اتفاق افتاده در فرآيند شدند که مشابه با تلاشي عنصر 118 بوده و نيمه عمر ميلي ثانيه اي داشته است.
4 سال پيش فيزيکداني به نام ويکتور نينوو به خاطر گزارش اشتباه درباره کشف عنصر 118 از طرف لابراتوار لورنس برکلي مورد خشم قرار گرفت.
يکي از اعضاي تيم مي گويد: چنين مساله اي ما را نگران کرده است و ما تمام تلاش خود را براي به حداقل رسانيدن خطا کرده ايم و هيچ شخصي مسوول تحليل داده ها نيست.
منبع: scientific american
شکل اوربیتال ها
|
نام اوربیتال |
شکل اوربیتال |
نام اوربیتال |
شکل اوربیتال |
|
1s
|
|
3py |
|
|
2s |
|
3pz
|
|
|
3s
|
|
3dxy
|
|
|
2px |
|
3dxz
|
|
|
2py
|
|
3dyz
|
|
|
2pz
|
|
3dz2 |
|
|
3px
|
|
3dx2-y2
|
|
شیمیدانهای نامی جهان اسلام
آغاز كیمیاگری اسلامی با اسامی مردانی همراه است كه احتمالا خود كیمیاگر نبودهاند، اما با گذشت زمان و فرارسیدن قرن دهم میلادی ، كیمیاگران شهیری از میان آنان برخاستند كه علاوه بر تفكراتشان ، نوشتارهای كاملا جدید و نوینی خلق كردند.
امام جعفر صادق علیه السلام (۱۴۸ ـ ۸۲ هـ . ق. / ۷۷۰ ـ ۷۰۵ م.)
محضر پر فیض حضرت امام صادق (ع) ، مجمع جویندگان علوم بود. با دانش پژوهی كه به محفل آن حضرت راه مییافت از خرمن لایزال دانش او بهره مند میشد. در علم كیمیا ایشان نخستین كسی بودند كه عقیده به عناصر چهارگانه (عناصر اربعه) آب ، آتش ، خاك و باد را متزلزل كردند. از فرمودههای ایشان است كه : «من تعجب میكنم مردی چون ارسطو چگونه متوجه نشده بود كه خاك یك عنصر نیست. بلكه عنصرهای متعددی در آن وجود دارد.» ایشان هزار سال پیش از پرسینلی ، لاووازیه و … دریافته بود كه در آب چیزی هست كه میسوزد (كه امروزه آن را هیدروژن مینامند).
فرآورده های نفتی

بشر از آغاز خلقت بدنبال چیزی بوده است که بتواند از آن حرارت، روشنایی و نیروی لازم برای گرداندن چرخ زندگی خود را فراهم نماید. برای تامین حرارت نخست شاخ و برگ درختان و زغال چوب را که در دسترس داشت، بکار میبرد. روشنایی لازم را نیز با مشعلهای چوبی یا چراغهای پیه سوز و رفته رفته با چراغهایی که با روغنهای گیاهی و روغنهای معدنی میسوخت، تامین میکرد.....
هیدروژن و فواید آن
هیدروژن ساده ترین عنصر شناخته شده برای انسان است؛ هر اتم هیدروژن تنها یك پروتون و یك نوترون دارد. هیدروژن فراوانترین گاز هستی است. ستاره ها در ابتدا از هیدروژن ساخته شده بودند. انرژی خورشید از هیدروژن به دست می آید. هیدروژن توپ عظیمی از گازهای هیدروژن و هلیوم است. درون خورشید، اتمهای هیدروژن تركیب می شود و اتمهای هلیوم را پدید می آورد. این پدیده گدازه « Pusiun » انرژی پرتوهای خورشید را تولید می كند.
انرژی پرتوی خورشید باعث برقراری حیات روی زمین است. این انرژی به ما نور می دهد، باعث رشد گیاهان می شود، بادها را به جریان می اندازد، باعث بارش باران می شود. این انرژی در سوختهای فسیلی ذخیره شده است. بیشتر انرژی مصرفی ما در حال حاضر از خورشید منشأ می گیرد. هیدروزن گازی (H2) روی زمین وجود ندارد. این عنصر همیشه به....
چرا وقتي در نوشابه نمک مي ريزيم, با شدت بيشتري گاز آزاد مي شود ؟
ـ ابتداي ماجرا :
هرچه دماي آب کمتر و فشار بيشتر باشد , ظرفيت پذيرش گاز بيشتري را خواهد داشت و به عنوان مثال CO2 بيشتري را در خود حل مي کند. هنگام توليد نوشابه با استفاده از اين خاصيت , در دماهاي پايين و فشار بالا , نوشيدني با تزريق گاز CO به حالت اشباع مي رسد. بنابراين وقتي در نوشابه باز شود و نوشابه در دما و فشار معمولي قرار گيرد , محلول خاصيت فوق اشباع دارد يعني مقدار CO2 حل شده در آن بيش از ظرفيت انحلال در آن دما و فشار است. چنين محلولي اگر شرايط مهيا باشد تمايل به آزاد کردن CO2 دارد. براي اين کار گاز CO2 محلول بايد به صورت حباب درآيد يعني مولکولهاي CO2 حل شده بايد در نقطه اي جمع شوند و با به هم پيوستن , يک حباب تشکيل دهند و به سطح نوشابه بيايند و از آن خارج شوند. اگر دقت کرده باشيد تشکيل حباب در سطوح تماس خارجي نوشابه اتفاق مي افتد يعني در سطح نوشابه و ديواره هاي بطري يا دورني . به زبان ساده اين سطوح و به خصوص نا همواري هاي موجود روي آنها يا هر نوع ناهمگني موجود در محيط نقش جايگاههاي تجمع يا مکانهايي براي به هم پيوستن مولکولها و تشکيل حباب را بازي مي کنند.به عبارت عاميانه يعني مولکولها براي ايجاد حباب دنبال بهانه مي گردند و اين بهانه را در اين سطوح پيدا مي کنند. در اين وضعيت ريختن نمک در نوشابه باعث خروج سريع تر گاز از محلول مي شود. زيرا سطح بيشتري براي تشکيل حباب در اختيار مولکولها قرار مي گيرد ( سطح جانبي بلورهاي نمک ) . چيزي مانند تبلور ( = بلور شدن ) شکر پس از قرار دادن بلور يا نخ در محلول فوق اشباع آن.بنابراين چنين اتفاقي اصلا شيميايي نيست. هيچ واکنشي هم صورت نمي گيرد و تقريبا هر ماده اي از نمک و شکر گرفته تا شن و ماسه که بتوانند نوعي ناهمگني در محيط نوشابه ايجاد کند يا سطح آزاد در اختيار آن قرار دهد ( يا به طور خلاصه بهانه دست مولکولها بدهد ! ) ميتواند اين کار را بکند . اين اتفاق را حتما در هنگام وارد کردن ني در نوشابه ديده ايد. تنها مزيت نمک با شکر اين است که به دليل داشتن دانه هاي ريز سطح جانبي نسبي بيشتري در مقايسه با مواد درشت تر دارند. همين! از اين به بعد مي توانيد در نوشابه دوستتان به جاي نمک خاک بريزيد !!!
ساختن موشک با استفاده از هيدروژن پري اکسيد و نقره
ساختن موشک با استفاده از هيدروژن پري اکسيد و نقره
براي اين کار هيدروژن پري اکسيد بايد غليظ شده باشد.(در حدود 90 درصد ) هيدروژن پري اکسيد که در دارو خانه ها ميفروشند غلظتش درحدود 3 در صد است. هيدروژن پري اکسيد وقتي با نقره واکنش برقرار ميکند نقره نقش کاتاليزور را بازي ميکند.اين واکنش اتم اضافه اکسيژن را ازاد کرده آب و گرماي زيادي توليد ميکند.گرما اب را به بخار تبديل کرده که اين بخار ميتواند با سرعت بالا از نازل موشک خارج کند.
براي ساخت موشک ميتوانيد از بطري نوشابه هاي خانواده خالي استفاده کنيد به اين صورت که در نوشابه را سوراخ کوچکي بکنيد(نقش نازل موشک) و مواد را در ان ريخته و در ان را ببنديد واکنش انجام شده و بخار با سرعت از سوراخ به بيرون زده و اگر بطري نوشابه را بروي زمين بخوابانيد اين موشک حرکت خواهد کرد.
تولید نانولوله های کربنی به شکل میکروسنسورهای شیمیایی آماده
قابلیت های نانولوله های کربنی به عنوان یک ماده ی بسیار خوب، اجتناب ناپذیر است. ولی یک عیب نانولوله های کربنی این است که وقتی برای اولین بار ساخته می شوند، به شکل توده ی ناخوشایندی از یک ماده ی سیاه دوده ای در ته یک لوله ی آزمایشی درمی آیند.
به گزارش پایگاه اطلاع رسانی صبا به نقل از ساینس دیلی، پژوهشگران دانشکده ی شیمی دانشگاه وارویک روش جدیدی برای تولید نانولوله های کربنی پیدا کرده اند که بلافاصله به شکل یک مدار الکتریکی آماده ی بسیار حساس درمی آید. پژوهشگران از رسوب سازی بخار شیمیایی و لیتوگرافی برای ساخت میکروالکترودهای آماده ی تک جداره که به شکل دیسک بوده و اساس ساختشان نانولوله های کربنی می باشد، استفاده کردند. نانولوله ها خودشان را ....
گاز طبیعی
گاز طبیعی
نفتی که از مخازن زیرزمین استخراج می شود ، مخلوط پیچیده ای از صدها ترکیب مختلفی است که از هیدروژن و کربن تشکیل شده است و این ترکیبات دارای خواص فیزیکی متفاوتی می باشند . جریان خروجی از چاه مخلوطی است از هیدروژن سولفور ( Associated gas ) و یا تبخیر همراه ( NON Associated ) و برای اینکه جهت استفاده و یا فراورش آماده گردد می بایستی از وجود ناخالصی ها و هیدروکربنهای مایع یا مایع شدنی عاری شود ، چون هر یک به نوبة خود می تواند در امر انتقال و یا استفاده از گاز طبیعی تولید اشکال نماید مادة عمدة تشکیل دهندة گاز طبیعی متان است . دیگر مواد همراه به ترتیب نزولی از نظر درصد حضورشان در این گاز عبارتند از : اتان و پروپان و بوتان و پنتان و البته به مقدار بسیار ناچیزی هیدروکربورهای اشباع شدة سنگین تر . البته طبیعت اکثراً ناخالصی هایی از قبیل انیدرید کربنیک و هیدروژن سولفوره و نیتروژن و بخار آب و گاهی نیز هلیوم همراه گاز طبیعی به ارمغان می دهد که این ارمغان در بعضی از موارد نوعی بی لطفی است چون که تصفیة گاز از این مواد بی اشکال و خالی....
کاربرد نانو تکنولوژی در صنعت نفت
کاربرد نانو تکنولوژی در صنعت نفت

هنگامی که ریچارد اسملی ( Richard Smally ) برندة جایزة نوبل، بالک مینسترفلورسنس را در سال 1985 در دانشگاه رایس کشف نمود، انتظار اندکی داشت که تحقیق او بتواند صنعت نفت را متأثر سازد. سازمان انرژی آمریکا ( DOE ) سرمایهگذاری خود را در قسمت فناوری نانو با 62 درصد افزایش داد تا مطالعات لازم در زمینة موادی با نامهای بالکیبالها ( Bulky Balls ) و بالکیتیوبها ( Bulky Tubes ) استوانههای .....
آشنایی با واحد پتروشیمی اصفهان
 شرکت سهامی پتروشیمی اصفهان ، اولین تولید کننده محصولات آروماتیکی در ایران یکی از طرحهای ملی و مهم دهه انقلاب می باشد که در سال 1371 با هدف تولید بیش از 200000 تن مواد در سال شامل بنزن ، تولوئن ، ارتوزایلین ، پارازایلین و مخلوط زایلین به جمع واحدهای تولیدی کشور پیوست.
شرکت سهامی پتروشیمی اصفهان ، اولین تولید کننده محصولات آروماتیکی در ایران یکی از طرحهای ملی و مهم دهه انقلاب می باشد که در سال 1371 با هدف تولید بیش از 200000 تن مواد در سال شامل بنزن ، تولوئن ، ارتوزایلین ، پارازایلین و مخلوط زایلین به جمع واحدهای تولیدی کشور پیوست.
این مجتمع از واحدهای زیربنایی کشور بوده و محصولات آن به عنوان خوراک صنایع پایین دستی نظیر شوینده ها ، پلاستیکها ، الیاف پلی استر ، نرم کننده های پلاستیکی ، رنگسازی و صنایع نظامی بکار برده می شود.
طراحی واحدهای مهم بر اساس پیشرفته ترین تکنولوژی جهان صورت گرفته و اولین مجتمع بزرگ کشور است که برای کنترل مراحل تولید آن از سیستم پیشرفته کامپیوتری D.C.S استفاده شده است.
شرکت پتروشیمی اصفهان از آغاز بهره برداری از واحدهای تولیدی خویش کیفیت را در تمامی زمینه های کاری بعنوان نخستین هدف به منظور جلب رضایت ....
شیمی

تاریخچه شیمی
واژه شیمی خود داستان درازی دارد. ریشه این نام در واژه کیمیاست. خاستگاه واژه کیمیا از زبان فارسی باستان است. این واژه و داستان دانش شگفت انگیز پشت آن به همراه دانشش به زبان عربی ...
تست معدنی
الف)ليتيم ب)روپيديم ج)فرانسيم د)سزيم
2-اندازه اتمهاي فلزات قليايي در هر دوره از همه.............. و انرژي يونش آنها در هر دوره از همه........... است.
الف)بيشتر-بيشتر ب)بيشتر- كمتر ج)كمتر- بيشتر د)كمتر- كمتر
3-در بين عناصر قليايي كدام عنصر داراي كمترين انرژي يونش است.
الف)ليتيم ب)روپيديم ج)فزانسيم د)سزيم
4-كدام گزينه در رابطه با واكنشهاي فلزات قليايي نادرست است.
الف)شدت واكنش فلز قليايي با آب با افزايش اندازه اتم كاهش مييابد.
ب)فلز قليايي به طور مستقيم با اكسيژن ، نيتروژن و گوگرد وارد واكنش ميشود.
ج)در نتيجه واكنش فلز قليايي با آب، گاز هيدروژن و محلول قليايي هيدروكسيد فلز توليد مي شود.
د)از واكنش مستقيم پتاسيم با اكسيژن، پتاسيم سوپراكسيد تشكيل مي شود.
5-در هالوژن بر هم كنش بين مولكولها از كدام نوع است.
الف)هيدروژني ب)فلزي ج)واندروالسي د)كوالانسي
6-كدام اسيد از همه ضعيفتر است.
الف)HI ب)HBr ج)HCl د)HF
7-كدام يك از تركيبات زير جهت سوخت موشك براي پرتاب فضاپيما استفاده ميشود.
الف)سديم هيپوكلريت ب)آمونيوم پركلرات ج)پتاسيم كلرات د)كلرو اسيد
8-در گروه فلزات قليايي، كدام گزيه از بالا به پايين افزايش نشان ميدهد.
الف)انرژي يونش ب)دماي جوش ج)شعاع اتمي د)دماي ذوب
9-رسانايي الكتريكي كداميك با افزايش دما، افزايش مييابد.
الف)فلزات واسطه ب)فلزات قليايي ج)نيم رساناها د)موارد الف وب
10-در ارتباط با ساختار فلزات كدام گزينه نادرست است.
الف) در يك فلز هرچه تعداد الكترونهاي شركت كننده در پيوند فلزي بيشتر باشد آن فلز چگالتر است.
ب)در گاليم نيروهاي پيوند فلزي حاكم بين اتمها فلز در حالت مايع بسيار ضعيف است.
ج)در فلزات واسطه معمولاً الكترونهاي تراز d در پيوند فلزي شركت ميكنند.
د)نيروي جاذبه الكتروستانيك بين يونهاي فلزي مثبت و الكترونهاي غير مستقر، همان پيوند فلزي است
تنظيم بترتيب ساختار کريستالي
مکعب

| Name | Sym | # |
|---|---|---|
| فلوئور | F | 9 |
| اکسيژن | O | 8 |
مکعبي مرکز پر

| Name | Sym | # |
|---|---|---|
| باريم | Ba | 56 |
| سزيم | Cs | 55 |
| کروم | Cr | 24 |
| اورپيم | Eu | 63 |
| فرانسيم | Fr | 87 |
| آهن | Fe | 26 |
| ليتيم | Li | 3 |
| منگنز | Mn | 25 |
| موليبدن | Mo | 42 |
| نيوبيم | Nb | 41 |
| پتاسيم | K | 19 |
| راديم | Ra | 88 |
| روبيديم | Rb | 37 |
| سديم | Na | 11 |
| تانتال | Ta | 73 |
| تنگستن | W | 74 |
| واناديم | V | 23 |
مکعبي با وجوه مرکز پر

| Name | Sym | # |
|---|---|---|
| اکتينيم | Ac | 89 |
| آلومينيم | Al | 13 |
| آرگون | Ar | 18 |
| کلسيم | Ca | 20 |
| سريم | Ce | 58 |
| مس | Cu | 29 |
| اينشتينيم | Es | 99 |
| ژرمانيم | Ge | 32 |
| طلا | Au | 79 |
| ايريديم | Ir | 77 |
| کريپتون | Kr | 36 |
| سرب | Pb | 82 |
| نئون | Ne | 10 |
| نيکل | Ni | 28 |
| پالاديم | Pd | 46 |
| پلاتين | Pt | 78 |
| رادون | Rn | 86 |
| روديم | Rh | 45 |
| سيليسيم | Si | 14 |
| نقره | Ag | 47 |
| استرانسيم | Sr | 38 |
| توريم | Th | 90 |
| زنون | Xe | 54 |
| ايتربيم | Yb | 70 |
هگزاگونال

| Name | Sym | # |
|---|---|---|
| امريسيم | Am | 95 |
| برکليم | Bk | 97 |
| بريليم | Be | 4 |
| کادميم | Cd | 48 |
| کاليفورنيم | Cf | 98 |
| کربن | C | 6 |
| کبالت | Co | 27 |
| کوريم | Cm | 96 |
| ديسپروسيم | Dy | 66 |
| اربيم | Er | 68 |
| گادولينيم | Gd | 64 |
| هافنيم | Hf | 72 |
| هليم | He | 2 |
| هولميم | Ho | 67 |
| هيدروژن | H | 1 |
| لانتان | La | 57 |
| لوتسيم | Lu | 71 |
| منيزيم | Mg | 12 |
| نئوديميم | Nd | 60 |
| نيتروژن | N | 7 |
| اسميم | Os | 76 |
| پرازئوديميم | Pr | 59 |
| پرومتيم | Pm | 61 |
| رنيم | Re | 75 |
| روتنيم | Ru | 44 |
| اسکانديم | Sc | 21 |
| سلنيم | Se | 34 |
| تکنسيم | Tc | 43 |
| تلوريم | Te | 52 |
| تربيم | Tb | 65 |
| تاليم | Tl | 81 |
| توليم | Tm | 69 |
| تيتانيم | Ti | 22 |
| ايتريم | Y | 39 |
| روي | Zn | 30 |
| زيرکونيم | Zr | 40 |
منوکلينيک

| Name | Sym | # |
|---|---|---|
| فسفر | P | 15 |
| پلوتونيم | Pu | 94 |
| پلونيم | Po | 84 |
اورتورومبيک

| Name | Sym | # |
|---|---|---|
| برم | Br | 35 |
| کلر | Cl | 17 |
| گاليم | Ga | 31 |
| يد | I | 53 |
| نپتونيم | Np | 93 |
| پروتاکتينيم | Pa | 91 |
| گوگرد | S | 16 |
| اورانيم | U | 92 |
رومبوهدرال

| Name | Sym | # |
|---|---|---|
| آنتيموان | Sb | 51 |
| آرسنيک | As | 33 |
| بيسموت | Bi | 83 |
| بور | B | 5 |
| جيوه | Hg | 80 |
| ساماريم | Sm | 62 |
تتراگونال

| Name | Sym | # |
|---|---|---|
| اينديم | In | 49 |
| قلع | Sn | 50 |
دانستنیها
@ تعداد چينيهايي که انگليسي بلدند، از تعداد آمريکاييهايي که انگليسي بلدند، بيشتر است!!!
@ دوئل کردن در پاراگوئه آزاد است به شرطي که طرفين خون خود را بر گردن بگيرند !!!
@ فيلها تنها حيواناتي هستند که نميتوانند بپرند.
@ هر بار که يک تمبر را ميليسيد 10/1 کالري انرژي مصرف ميکنيد.
@ فورييه 1865 تنها زماني بود که ماه کامل نشد.
@ کوتاهترين جمله کامل در زبان انگليسي I am است.
@ اگر عروسک باربي را زنده تصور کنيد سايزش 33-23-39 و قدش 2 متر و 15 سانتيمتر خواهد بود با گردني 2 برابر بلندتر از يک انسان نرمال !!!
@ تمام خرسهاي قطبي، چپ دست هستند.
@ اگر يک ماهي قرمز را در يک اتاق تاريک قرار دهيد، کم کم رنگش سفيد ميشود.
@ اگر به صورت مداوم 8 سال و 7 ماه و 6 روز فرياد بزنيد، انرژي صوتي لازم براي گرم کردن يک فنجان قهوه را توليد کردهايد.
@ در مصر باستان افراد روحاني تمام موهاي بدن خود را ميکندند حتي ابروها و موژهها.
@ کوتاهترين جنگ در تاريخ در سال 1896 بين زانزيبار و انگلستان رخ داد که 38 دقيقه طول کشيد !!!
@ در 4000 سال گذشته هيچ حيوان جديدي رام نشده است.
@ هيچ وقت نميتواني با چشمان باز عطسه کني.
@ چشمهاي ما از بدو تولد همين اندازه بودهاند، اما رشد دماغ و گوش ما هيچوقت متوقف نميشوند.
@ هر تکه کاغذ را نميتوان بيش از 9 بار تا کرد.
@ در هرم خئوپوس در مصر که 2600 سال قبل از مبلاد ساخته شده است، به اندازهاي سنگ به کار رفته که ميتوان با آن ديواري آجري به ارتفاع 50 سانتيمتر دور دنيا ساخت !!!
@ اگرتمام رگهاي خوني را در يک خط بگذاريم، تقريبا 97000 کيلومتر ميشود.
@ وقتي مگس بر روي يک ميله فولادي مينشيند، ميله فولادي به اندازه دو ميليونيم ميليمتر خم ميشود.
@ آمريکا تا 50 ميليون سال ديگر دو نيم خواهد شد.
@ عدد 2520 را ميتوان بر اعداد 1 تا 10 تقسيم نمود، بدون آنکه خارج قسمت کسري داشته باشد.
@ 3330 برابر مردمي که امروزه بر سطح زمين زندگي ميکنند، در زير خاک مدفون شدهاند.
@ تنها حيواني که نميتواند شنا کند، شتر است.
@ شيشه در ظاهر جامد به نظر ميرسد ولي در واقع مايعي است که بسيار کند حرکت ميکند.
@ در هر ثانيه بيش از 5000 بيليون بيليون الکترون به صفحه تلويزيون برخورد ميکند و تصويري را که شما تماشا ميکنيد، بوجود ميآورد.
@ شانس شبيه بودن دو اثر انگشت، يک به 64 ميليارد است.
@ يک ليتر سرکه در زمستان سنگينتر از تابستان است.
@ قد انسان تا 20، 25 سالگي و گاها 40 سالگي بلند ميشود و از چهل سالگي به بعد، قد انسان هر دو سال حدود 6 ميليمتر کوتاه ميشود !
@ فقط با از دست دادن يک درصد از آب بدن، احساس تشنگي ميکنيم !
@ دهان انسان روزانه يک ليتر بزاق توليد ميکند.
@ چيتا يا يوزپلنگ سريعترين حيوان خشکي است. او در عرض فقط 3 ثانيه 100 کيلومتر در ساعت سرعت ميگيرد. رکوردي که حتي سريعترين خودروهاي فراري هم نتوانستهاند بشکنند.
@ کرمهاي ابریشم در 56 روز، 86 هزار برابر خود غذا ميخورند.
@ تنها قسمت بدن که خون ندارد، قرينه چشم است.
@ شتر در 3 دقيقه 95 ليتر آب ميخورد !!!
اگر كسي را دوست داري
شكسپير : اگر كسي را دوست داري رهايش كن سوي تو برگشت از آن توست و اگر برنگشت از اول براي تو نبوده
دانشجوي زيست شناسي : اگر كسي را دوست داري ، به حال خود رهايش كن ... او تكامل خواهد يافت
دانشجوي آمار : اگر كسي را دوست داري ، به حال خود رهايش كن ... اگر دوستت داشته باشد ، احتمال برگشتنش زياد است و اگر نه احتمال ايجاد يك رابطه مجدد غير ممكن است
دانشجوي فيزيك : اگر كسي را دوست داري ، به حال خود رهايش كن ...اگر برگشت ، به خاطر قانون جاذبه است و اگر نه يا اصطكاك بيشتر از انرژي بوده و يا زاويه برخورد ميان دو شيء با زاويه صحيح هماهنگ نبوده است
دانشجوي حسابداري : اگر كسي را دوست داري ، به حال خود رهايش كن ... اگر برگشت ، رسيد انبار صادر كن و اگر نه ، برايش اعلاميه بدهكار بفرست
دانشجوي رياضي : اگر كسي را دوست داري ، به حال خود رهايش كن ... اگر برگشت ، طبق قانون 2=1+1 عمل كرده و اگر نه در عدد صفر ضربش كن
دانشجوي كامپيوتر : اگر كسي را دوست داري ، به حال خود رهايش كن ... اگر برگشت ، از دستور كپي - پيست استفاده كن و اگر نه بهتر است كه ديليت اش كني
دانشجوي خوشبين : اگر كسي را دوست داري ، به حال خود رهايش كن... نگران نباش بر مي گردد
دانشجوي عجول : اگر كسي را دوست داري ، به حال خود رهايش كن ... اگر در مدت زماني معين بر نگشت فراموشش كن
دانشجوي شكاك : اگر كسي را دوست داري ، به حال خود رهايش كن ...اگر برگشت ، از او بپرس " چرا " ؟
دانشجوي صبور : اگر كسي را دوست داري ، به حال خود رهايش كن ...اگر برنگشت ، منتظرش بمان تا برگردد
دانشجوي رشته تاریخ : اگر كسي را دوست داري ، به حال خود رهايش كن ...اگر برگشت ، باز هم به حال خود رهايش كن ، اين كار را مرتب تكرار
چهار دانشجو
اما وقتی به شهر خود برگشتند متوجه شدند که در مورد تاریخ امتحان اشتباه کرده اند و به جای سه شنبه، امتحان دوشنبه صبح بوده است. بنابراین تصمیم گرفتند استاد خود را پیدا کنند وعلت جا ماندن از امتحان را برای او توضیح دهند.
آنها به استاد گفتند:
«ما به شهر دیگری رفته بودیم که در راه برگشت لاستیک خودرومان پنچر شد و از آنجایی که زاپاس نداشتیم تا مدت زمان طولانی نتوانستیم کسی را گیر بیاوریم و از او کمک بگیریم، به همین دلیل دوشنبه دیر وقت به خانه رسیدیم.»
استاد فکری کرد و پذیرفت که آنها روز بعد امتحان بدهند.
چهار دانشجو روز بعد به دانشگاه رفتند و استاد آنها را به چهار اتاق جداگانه فرستاد و به هر یک ورقه امتحانی را داد و از آنها خواست که شروع کنند....
آنها به اولین مسأله نگاه کردند که 5 نمره داشت. سوال خیلی آسان بود و به راحتی به آن پاسخ دادند.
سپس ورقه را برگرداندند تا به سوالی که 95 نمره داشت پاسخ بدهند.
سوال این بود: کدام لاستیک پنچر شده بود؟!
عید ولایت و امامت

دوستان عزیز سلام
فرارسیدن عید غدیر، عید ولایت و امامت را به محضر امام زمانمان، حضرت مهدی(عجل الله تعالی فرجه الشریف) و به محضر همه كسانی كه مست جام ولایت مولا امیرالمومنین علی علیه السلام هستند؛ تبریك و تهنیت عرض مینماییم.
استخراج کافئین از چای
50 گرم چای را در یک بشر یک لیتری ریخته با 500 میلی لیتر آب حدود 25 دقیقه بجوشانید. در یک بشر دیگر به وسیله پارچه آنرا صاف کنید و در همان حال ظرف محلول صاف شده باید روی اجاق باشد تا محلول سرد نشود. همراه با به همزدن 150 میلی لیتر محلول 10% بازی استات سرب به آن اضافه کنید. تانین رسوب میکند. محلول گرم را صاف کنید. محلول را با اسید سولفوریک رقیق واکنش دهید تا سولفات سرب رسوب کند. رسوب را صاف کنید. به محلول 5 گرم کربن اکتیو اضافه کنید و حرارت دهید تا حجم آن حدود 200 – 150 میلی لیتر بشود. محلول را صاف کنید و با 25 میلی لیتر کلروفرم تکان دهید. لایه کلروفرم را در قیف جدا کننده جدا کنید. استخراج با 25 میلی لیتر کلروفرم را 3 مرتبه انجام دهید. به وسیله تقطیر، بیشتر کلروفرم را خارج کنید. باقی مانده را در مقدار کمی آب گرم حل کنید و محلول را با تبخیر آهسته فشرده کنید. کافئین مانند رشته های ابریشم جدا میشود. محصول کافئین با یک مولکول آب همراه است که اگر تا 100 درجه سانتیگراد آنرا گرم کنید آبش را از دست میدهد.
تبلور ( کریستالیزه کردن )
تبلور ( کریستالیزه کردن )
تبلور یکی از تکنیک های خالص سازی است و يكي از بهترين روشهاي تخليص اجسام جامد است که در آن ماده جامد ناخالص در حداقل مقدار حلال داغ حل می شود و در اثر سرد کردن در محلول رسوب میکند.
روش عمومي تبلور عبارت است از :
● حل كردن جسم در حلال مناسب به كمك گرما و تهيه محلول سير شده از جسم
● صاف كردن سريع محلول گرم
● سرد كردن تدريجي محلول صاف شده به منظور راسب كردن جسم به شكل بلور
● صاف كردن و شستن بلورها با حلال سرد و خشك كردن آنها
● تعيين نقطه ذوب بلور
عوامل تاثیر گذار در حلالیت:
1- خصوصیات حلال ( قطبی یا غیرقطبی )
2- حجم حلال
3- دمای حلال ( حلالیت با افزایش دما افزایش میابد )
انتخاب حلال مناسب نكته اساسي و مهم در عمل تبلور محسوب مي شود. حلال مناسب حلالي است كه در دماي معمولي جسم را به مقدار جزئي در خود حل كند، ولي در گرما و به ويژه در دماي جوش، اين انحلال به آساني صورت گيرد. عامل ديگر در انتخاب حلال مناسب، توجه به قطبيت آن است كه با توجه به ساختمان ماده مورد نظر انتخاب مي شود. زيرا تركيبات قطبي در حلالهاي قطبي و تركيبات غير قطبي در حلالهاي غير قطبي حل مي شوند.
به هنگام انتخاب حلال مناسب براي تبلور، به نكات زير باید توجه کرد :
● حلال در دماي معمولي ( دماي آزمايشگاه ) نباید تركيب را حل كند، اما در نقطه جوش خود بايد حداكثر تركيب يا تمام آن را در خود حل كند.
● نقطه جوش حلال نبايد از نقطه ذوب تركيب مورد نظر بيشتر باشد. زيرا در اين صورت، پيش از اينكه دماي حلال به نقطه جوش آن برسد، جسم در حلال ذوب مي شود. ( در پديده تبلور، جسم بايد در حلال حل شود).
● حلال و جسم حل شده نبايد با هم واكنش بدهند.
● تا حد امكان نقطه جوش حلال پايين باشد تا به آساني تبخير شود.
حلال های مورد استفاده در تبلور ( کریستالیزه کردن )

چند نکته در مورد عمل تبلور ( کریستالیزه کردن )
● چنانچه محلول به شدت رنگي و يا ناخالص باشد، گرم كردن را قطع كنيد پس از اينكه محلول، اندكي خنك شد، كمي پودر زغال به آن اضافه كنيد. زغال به دليل دارا بودن سطح فعال زياد مي تواند ناخالص يها و رنگ را به خود جذب كند. سپس مجددا محلول را گرم كنيد.
● برای تسریع در عمل تبلور يك تكه از بلور تركيب را به عنوان هسته اوليه در ظرف بيندازيد اين عمل را بذرافشاني مي نامند.
روش تهیه صابون
روش تهیه صابون
عمل هیدرولیز چربی یا روغن را اصطلاحا صابونی کردن مینامند. برای این کار، چربی (a) را با محلول سود حرارت میدهند. در نتیجه گلیسرین (b) و مخلوطی از نمک سدیم اسیدهای چرب (c) مطابق واکنش زیر حاصل میشود:
چربیها و روغنهای طبیعی استر اسیدهای آلیفاتیک یک ظرفیتی با تعداد اتمهای کربن زوج و گلیسرین میباشند که آنها را گلیسرید نیز مینامند. چربیها و روغنها به طور کلی دارای ساختمان (a) میباشند. چربیها جامد و روغنها مایع میباشند. نقطه ذوب چربیها بالاتر از نقطه ذوب روغنها است. این اختلاف بستگی به نوع و مقدار اسید مربوطه دارد. هرچه مقدار اسیدهای اشباع نشده در ساختمان یک چربی بیشتر باشد، نقطه ذوب پایین تری دارد. اگر چربی تنها از اسیدهای اشباع شده تشکیل شده باشد مانند پیه گوسفند و غیره نقطه ذوب بالا خواهد داشت.
روغنهای نباتی مانند روغن زیتون، خرما، نارگیل و کرچک علاوه بر این که دارای اسیدهای چرب (اولئیک، استئاریک و پالمیتیک) هستند، اسیدهای اشباع نشده با چند پیوند دوگانه مانند اسید لینولئیک به فرمول زیر نیز در ساختمان آنها شرکت میکنند.
مولكولهاي صابون د اراي يك انتهاي قطبي است كه در آب حل مي شود و انتهاي ديگر آن يك دنباله طويل هيدروكربن است كه در روغن محلول است واين عامل باعث ميشود تا مثل يك واسطه چربيها را در آب حل كند.
ابتدا یون هیدروکسید به عنوان نوکلئوفیل (هسته دوست) به کربن گروه کربنیل حمله کرده، پس از خارج شدن یک مولکول الکل، انیون اسید به صورت هیبرید رزونانس فوق، پایدار میگردد.
روش تهیه
50 گرم چربی را در یک بشر 250 میلی لیتری ریخته و به طور ملایم آنرا حرارت دهید تا ذوب شود (دما نباید از 70 درجه بالاتر برود).
در حالیکه چربی را حرارت میدهید ضمن به همزدن مداوم محلول سود (7گرم در 50 میلی لیتر آب) را در قسمتهای 5 میلی لیتر به چربی اضافه کنید. پس از افزودن اولین 5 میلی لیتر سود، زمان اضافه نمودن 5 میلی لیتر بعدی وقتی است که سود اضافه شده قبلی تقریبا مصرف شده باشد. (برای اطمینان از مصرف سود، نوک اسپاتول را در بشر فرو برده و یک قطره معرف فنل فتالئین روی آن بچکانید، چنانچه رنگ آن فورا ارغوانی شد دلیل آن است که هنوز سود در محیط وجود دارد و باید به هم زدن را ادامه داد).
پس از افزودن آخرین قسمت سود، آنقدر به هم بزنید تا صابون یک حالت کشدار به خود بگیرد (بوی صابون در این حالت به خوبی استشمام میشود.) صابون حاصل را در قالب ریخته و بگذارید یک هفته بماند تا عمل صابونی شدن کامل شود. صابون حاصل دارای مقدار زیادی گلیسیرین است، چنانچه بخواهند گلیسیرین آنرا جدا کنند، قبل از ریختن در قالب، صابون را به مدت 24 ساعت در محلول اشباع شده نمک طعام قرار میدهند، سپس قرص صابون را از درون ظرف خارج کرده و پس از شستن به قطعات کوچک تقسیم نموده، در هوا خشک میکنند.
روش دیگر
در یک بالن، ۵۰ میلی لیتر روغن مایع را با ۴۰ میلی لیتر اتانول و ۳ گرم پتاسیم هیدروکسید ریخته و بمدت نیم ساعت رفلاکس کنید. پس از اتمام این مدت چند قطره از مخلوط را در مقدار کمی آب حل کنید که اگر قطره روغنی روی آب قرار نگرفت واکنش پایان یافته و اگر روغن در سطح آب مشاهده شد عمل رفلاکس را به مدت 15 دقیقه دیگر ادامه دهید. سپس الکل موجود در مخلوط را به وسیله تقطیر ساده جدا کنید و ماده باقیمانده در بالن را در cc 75 آب مقطر گرم حل کنید. دقت کنید که حتما الکل موجود در بالن از مخلوط خارج شود سپس آزمایش زیر را انجام دهید.
الف) مقدار 25 میلی لیتر محلول به دست آمده را به 25 میلی لیتر آب نمک اشباع به آهستگی اضافه کنید مخلوط را صاف کرده و ماده جامد که صابون میباشد روی کاغذ صافی میماند. آنرا با آب نمک اشباع بشوئید و صابون را در روی یک ظرف شیشه ای پهن کنید.
ب) مقدار 10 میلی لیتر آب شهر را با 10 میلی لیتر محلول صابون مخلوط کرده تکان دهید و نتیجه را گزارش کنید.
از نظر تئوری، میتوان از واکنش هر نوع روغن یا چربی با هیدروکسیدسدیم یا پتاسیم، صابون درست کرد. شما هم میتوانید از چربی های حیوانی یا روغن های گیاهی (مثل روغن نارگیل) استفاده کنید. ساختن صابون هم مانند تمام واکنش های شیمیایی دیگر است. کیفیت صابونی که درست میکنید به خلوص مواد اولیه، شرایط واکنش و دقت شما در انجام آزمایش وابسته است.
در این فعالیت میخواهیم تا با استفاده از مخلوط روغن نارگیل و روغن زیتون و واکنش دادن آن با هیدروکسید سدیم (سود سوزآور) یک صابون جدید بسازیم. میتوانید با خیال راحت دستان خودتان را با این صابون بشویید، چون گلیسیرین تولید شده در واکنش (به عنوان یک محصول فرعی واکنش صابون سازی) در صابون باقی میماند. گلیسیرین نرم کننده پوست است. آزمایش حدودا سه ساعت طول میکشد، اما باید چهار تا شش هفته صبر کنید تا بتوانید از صابون استفاده کنید.
مواد لازم:
برای درست کردن 250 گرم صابون، لازم است تا مواد زیر را تهیه کنید:
• 32 گرم سود سوزآور (هیدروکسید سدیم) جامد
• 125 گرم روغن نباتی
• 55 گرم روغن زیتون خالص
• 55 گرم روغن نارگیل
• 100 میلی لیتر آب مقطر یا آب باران (از آب لوله کشی استفاده نکنید.)
• 5 گرم آبلیمو یا اسانس برای معطر کردن صابون
• عینک آزمایشگاه
• دستکش پلاستیکی
• پیش بند پارچه ای (نه نایلونی)
• پیمانه پلاستیکی یا شیشه ای
• دو ظرف شیشه ای مقاوم در برابر حرارت به حجم یک لیتر
• دو قاشق غذاخوری پلاستیکی (یکی برای روغن و یکی برای محلول هیدروکسید سدیم)
• دماسنج (صفر تا 100 درجه سانتی گراد)
• قالب
• روزنامه
این مواد را میتوانید از مغازه های مواد شیمیایی یا مواد غذایی تهیه کنید.
قبل از شروع کار، حتما به موارد زیر توجه کنید:
• حتما از دستکش و عینک ایمنی استفاده کنید. پیش بند را هم ببندید که وقتی محلول داغ پلق پلق میکند، روی لباستان نریزد.
• پیش از اینکه درب ظرف حاوی هیدروکسید سدیم را باز کنید، توصیه های ایمنی روی آن را کاملا مطالعه کنید. هیدروکسید سدیم یک قلیای قوی است و در صورت تماس با پوست، آن را میسوزاند. علاوه بر این، به بیشتر ظرف های آشپزخانه نیز صدمه میزند.
اگر سود روی پوستتان ریخت، تا زمانی که دیگر احساس نکنید پوستتان صابونی است، آن را با آب بشویید.
اگر با چشمتان تماس پیدا کرد، سریعا چشم را با آب سرد بشویید، و فورا به پزشک مراجعه کنید.
اگر با دهانتان تماس پیدا کرد، آن را با آب بشویید و این کار را تا زمانی که طعم ناخوشایند آن برطرف شود، ادامه دهید.
هرگز از ظرف آلومینیومی یا روی استفاده نکنید، چون با سود سوزآور واکنش میدهند.
یک ظرف بزرگ پر از آب سرد پیش خود نگهدارید، تا در صورت وقوع حادثه از آن استفاده کنید.
• موقع کار چیزی نخورید و نیاشامید. کودکان را از محل انجام آزمایش دور نگهدارید و مواد شیمیایی را در دسترس آنها قرار ندهید.
• در محیطی کار کنید که هوا جریان داشته باشد تا بخارات مواد شیمیایی را تنفس نکنید.
روند کار:
ابتدا دستکش را دست کنید. پیش بند و عینک را ببندید.
1. توصیه میکنیم این مرحله را در فضای باز انجام دهید. 200 میلی لیتر آب مقطر سرد را در یکی از ظرفها بریزید و سود را به آرامی و در حالی که محلول را هم میزنید، به آن بیفزایید. هیچ وقت آب را روی سود نریزید. به هیچ وجه بخارات ناشی از هم زدن را تنفس نکنید. دمای محلول به تدریج بالا میرود و تمام سود در آب حل میشود. صبر کنید تا محلول خنک شود و دمای آن به 45 درجه سانتی گراد برسد.
|
|
2. سپس روغن نباتی، روغن زیتون و روغن نارگیل را وزن کنید و در ظرف دوم بریزید. ظرف را در آب گرم بگذارید تا کم کم گرم شود و دمای آن به 45 درجه سانتی گراد برسد. دقت کنید که دما از 50 درجه سانتی گراد بالاتر نرود.
3. وقتی دمای هر دو ظرف در حدود 45 درجه سانتی گراد بود، به آرامی محلول هیدروکسید سدیم را به روغنها اضافه کنید. مخلوط را با یک قاشق به مدت 15 دقیقه به خوبی هم بزنید.
4. پیشرفت واکنش به زمان احتیاج دارد. درست کردن صابون از بعضی روغنها ممکن است چند هفته طول بکشد، اما به هر حال بعد از 5 الی 10 دقیقه متوجه یک سری تغییرات خواهید شد. مخلوط کم کم غلیظ میشود.
محلول را به آرامی به هم بزنید. این کار را به مدت 5 دقیقه ادامه دهید و سپس در 15 دقیقه آن را به حال خود بگذارید. این سیر را به همین شکل ادامه دهید. پس از گذشت حدود یک ساعت مخلوط مانند فرنی غلیظ میشود.
ممکن است فکر کنید این که مثل آشپزی بود، اما در واقع شما یک آزمایش شیمیایی انجام داده اید. با پیشرفت واکنش، روغن و چربی با سود واکنش میدهد و گرما تولید میکند. حرارت باعث تبخیر آب میشود و صابون به تدریج سفت میشود.
5. اگر میخواهید صابون بوی خوبی داشته باشد، اسانس یا آبلیمو را در این مرحله به آن اضافه کنید.
6. محتوای ظرف را در قالب بریزید و آن را در محل گرم و خشکی قرار دهید.
|
|
7. محل کار خود را تمیز کنید و ظرفها را با محلول آب صابون داغ بشویید.
8. بعد از گذشت حدودا یک هفته، صابون به اندازه کافی سفت میشود و میتوانید آن را از قالب جدا کنید. برای این کار از دستکش استفاده کنید، چون هنوز مقداری از سود که در واکنش شرکت نکرده است، داخل صابون وجود دارد. برای اینکه بتوانید از صابون استفاده کنید باید دو یا سه هفته دیگر صبر کنید. صابون را روی روزنامه بگذارید و آن را در هوای باز و در محلی با دمای 20 تا 25 درجه سانتی گراد قرار دهید، تا واکنش به طور کامل انجام شود. هر چه بیشتر صبر کنید، صابون بهتری خواهید داشت.
تا زمانی که مطمئن نشده اید کل سود مصرف شده، از صابون استفاده نکنید! حتی وقتی مطمئن شدید از آن برای شستن صورت استفاده نکنید، اما میتوانید دستهایتان را با آن بشویید.
اگر دوست داشته باشید، میتوانید روغنهای مختلف را امتحان کنید. تغییر دادن زمان واکنش هم کار هیجان انگیزی است. اگر به صابونتان رنگ خوراکی بزنید، ظاهر بهتری پیدا میکند. کار شیمی دانها هم شبیه کار شماست. آنها هم مواد اولیه و شرایط مختلف واکنش را امتحان میکنند تا به نتیجه ای که میخواهند، برسند.
استر
CH3CH2OH + HOCOCH3 CH3CHOCOCH3
درواقع گروه عاملي استر به صورت –O-C=O است كه هم اكسيژن سمت چپ و هم كربن گروه C=O خود به هيدروكربن هاي ديگر متصل مي باشند. استرهاي حلقهاي نيز كه لاكتون ناميده ميشوند، جزو گروه استرها ميباشند.
خواص استر
استرها غالبا فرار و معطرند و برخي از آنها در ميوههاي رسيده يافت ميشوند. مثلا استات ايزوپنتيل ، بوي موز ميدهد والرات ايزوپنتيل بوي سيب و پروپيونات ايزوبوتيل ، بوي نيشكر ميدهند.
موارد استفاده از استر
خيلي از استرها مانند استات اتيل و استات بوتيل ، بعنوان واكنشگر و يا حلال و نرم كننده رزينها در آزمايشگاهها و صنعت مورد استفاده قرار ميگيرند.
استرهاي طبيعي
مومها
چربيها و روغنها و مومهايي كه در طبيعت يافت ميشوند، حاوي استرهايي با جرم مولكولي بالا ميباشند كه به ليپيد موسومند. مومها مخلوط پيچيدهاي از استرها ، الكلها و آلكانهاي با زنجير طويل ميباشند، ولي جزء اصلي تشكيل دهنده آنها ، استرهايي ميباشند كه از واكنش اسيدهاي چرب و الكلهاي با زنجير طويل بوجود ميآيند.
از جداسازي و مطالعه مواد تشكيل دهنده موم زنبور عسل معلوم شده است كه ميريسيل پالميتات ، بيشترين مقدار آن را تشكيل ميدهد كه يك استر است.
چربيهاي جامد و روغنهاي مايع
چربيهاي جامد و روغنهاي مايع ، استرهايي هستند كه از واكنش اسيد چرب سنگين و گلسيرين بوجود ميآيند و گليسيريد ناميده ميشوند. تعداد كربن اسيدها بين هشت تا بيست و دو ميباشد. مطالعات نشان داده است كه اسيدهاي موجود در استرها ممكن است از يك نوع نباشند و بطور اتفاقي روي گليسيرين قرار گرفته باشند. بعنوان مثال ، يك مولكول گلسيرين ممكن است به سه گروه استئارات يا يك مولكول پالمتيات و دو مولكول استئارات و … متصل شده باشد.
مهمترين اسيدهاي چرب اشباع شدهاي كه از هيدروليز چربيها و روغنها بدست آمدهاند، عبارتند از: اسيد لوريك (Lauric acid) ، اسيد پالمتيك (Palmitic acid) ، اسيد استئاريك (Stearic acid). روغنهاي مايع به مقدار زياد ، گليسيريدهاي اسيدهاي چرب اشباع نشده هستند. مهمترين اسيدهاي اشباع نشده ، C_18 ميباشند.
روغنهاي مايع به علت داشتن پيوندهاي ? آسيب پذيرند و لذا با هيدروژندار كردن كاتاليزوري ، پيوندهاي دوگانه را از بين ميبرند تا نگهداري آنها آسانتر گردد. خيلي از روغنهاي جامدي كه در آشپزي مورد استفاده قرار ميگيرند، از هيدروژندار كردن روغن دانهها و غلات تهيه ميشوند. هيدروژندار كردن چربيها ، با اينكه امكان نگهداري اين مواد را فراهم ميسازد، ولي هضم آنها را در متابوليسم با اشكالي مواجه ميسازد.
در سالهاي اخير ، معلوم شده است كه اين چربيها موجب مسدود شدن رگهاي خوني و امراض قلبي ميگردند.
روش تهيه استرها و لاكتونها
اولين و قديميترين روش سنتز استرها ، واكنش اسيدهاي آلي با الكلها در حضور اسيد معدني(معمولا اسيد سولفوريك) ميباشد. با اين روش ، ميتوان خيلي از استرها را بطور مستقيم سنتز نمود كه اين روش ، روش فيشر (Fisher) ناميده ميشود. در مواقعي كه اسيد يا الكل بكار رفته ، ارزان قيمت باشد، ميتوان مقدار يكي از واكنشگرها را چند برابر دومي انتخاب كرد و تعادل را به نفع تشكيل محصول بيشتر جابجا كرد و استر بيشتري بدست آورد.
گاهي اوقات براي حصول نتيجه بهتر ، ميتوان يكي از محصولات را از محيط خارج كرد و در نتيجه ، واكنش را به سمت تشكيل محصول بيشتر سوق داد.
صابوني شدن
استرها در محلولهاي قليايي آبكي تحت حمله قرار ميگيرند و نمك اسيد آلي را توليد مينمايند. اين واكنش به صابوني شدن موسوم ميباشد. براي تائيد صحت مكانيسم واكنش از استرهاي حاوي اكسيژن با جرم اتمي 18 كه يك اتم ايزوتوپ است، استفاده ميشود و مشاهده ميگردد كه اتم اكسيژن سنگين همراه الكل آزاد ميشود و نشان ميدهد كه حمله هسته خواهي به گروه كربونيل استر انجام شده است
ولادت امام رضا
ولادت امام رضا (ع) بر كليه مسلمين جهان مبارك باد

امشب از آيينه ها آواز يا هو مي وزد
دارد از حيراني چشمت هياهو مي وزد
پلک واکن هر چه مي خواهم تماشايت کنم
در نگاه تند چشمان تو آهو مي وزد
باز گرداگرد ايوان تو پرپر مي زنم
باز هم از چار سوي عرش هوهو مي وزد
من هم آوازتو احساس غريبي مي کنم
اي که از دلتنگي ات عطر پرستو مي وزد
باد مي رقصد ميان نقش گنبدهاي تو
از تن گلدسته ها انگار شب بو مي وزد
شعر من مثل غزالان پريشان شما
در نسيم خانه ات اين سو و آن سو مي وزد
آب تبلور
آب تبلور به چه معناست؟
آب تبلور آبي است كه به همراه مولكولهاي بعضي بلورهاي جامدهاي يوني است. هنگامي كه يك جامد يوني از محلول آبي متبلور ميشود به عنوان مثال باريم كلريد محلول در آب است و ما به وسيلهي تبخير يك مقدار از محلول و اشباع كردن محلول، مقداري بلور BaCl2 بدست ميآوريم. در اين هنگام تعدادي از مولكولهاي آب در شبكه بلور به دام افتاده و با بلور پيوندهاي ضعيف واندروالسي برقرار ميكند. در اين هنگام ما به جاي BaCl2 خالص، نمك متبلور آن را داريم و فرمول آن به صورت ((BaCl2, 2H2O(s) ميباشد. به اين گونه بلورهاي نمكي كه با مولكولهاي آب همراه هستند، هيدرات و به آبي كه اين بلورها را همراهي مي كند و در شبكه بلوري اين نمكها وارد شده است، آب تبلور گفته ميشود. مثال ديگر از اين دست، سولفات مس هيدراته است كه داراي 5 مولكول آب تبلور ميباشد:( (CuSO4, 5H2O (s)
معمولا" ظاهر هيدراتها با تركيبات بيآب آنها كاملا" تفاوت دارد. به طور معمول، هيدراتها بلورهاي نسبتا" بزرگ و غالبا" شفاف تشكيل ميدهند. هيدراتها بر اثر گرم شدن تجزيه ميشوند و آب تبلور خود را به صورت بخار آب از دست ميدهند.
BaCl2, 2H2O(s) à BaCl2 (s) + 2H2O(g(
از بين رفتن آب تبلور يك هيدرات را شكوفا شدن مينامند.
رنگ برخي از نمك هاي آب پوشيده با رنگ نمك بي آب آنها متفاوت است، از اين رو، از اين نمكها به عنوان شناساگر رطوبت استفاده مي كنند. مثلا"
قرمز رنگ CoCl2.2H2O
صورتي رنگ CoCl2.5H2O
بنفش رنگ CoCl2.4H2O
آبي رنگ CoCl2
مسائل مربوط متبلور معمولا" به اين صورت است كه مقدار مشخصي از نمك را حرارت داده و وزن آن در اثر تبخير آب درون آن كاسته مي شود. از روي كاهش وزن داده شده از ما مي خواهند كه نسبت آب به نمك را محاسبه كنيم. به عنوان مثال:
023/1 گرم نمك آب پوشيده ي مس II سولفات را در يك بوته چيني حرارت مي دهيم تا آب آن بخار شود. 654/0 گرم نمك بي آب مس II سولفات در بوته باقي مي ماند. حساب كنيد به ازاي هر مول CuSO4، چند مول آب در نمك آبدار وجود داشته است.(جرم مولي مس، گوگرد، اكسيژن و هيدروژن به ترتيب 64، 32، 16 و 1 گرم بر مول است.)
براي حل اين گونه سوالات بايد سه مرحله طي كنيم:
1- ابتدا اين رابطه را بنويسيم و جرم هر يك از اين گونه ها را حساب كنيم: آ- جرم نمك آبدار ب- جرم نمك بي آب ج- جرم آب و اين رابطه را برايش بنويسيم:
جرم نمك آبدار = جرم نمك بي آب + جرم آب
2- تبديل كردن جرم نمك بي آب به مول
3- تبديل كردن جرم آب به مول
4- بدست اوردن نسبت مولي آب به نمك به وسيله ي تقسيم كردن مرحله ي 4 به مرحله ي 3
پس با استفاده از مرحله ي اول، ابتدا جرم آب بخار شده را حساب كنيم:
جرم آب بخار شده= جرم نمك آب پوشيده – جرم نمك بي آب
369/0 = 654/0 - 023/1
بنابراين مقدار آب بخار شده برابر 369/0 گرم مي باشد.
2- حال بايد تعداد مول نمك بي آب را محاسبه مي نماييم. براي اين منظور جرم نمك مورد نظر را در معكوس جرم مولي آن ضرب مي نماييم.
= تعداد مول نمك بي آب
Mol 004/0=g CuSO4 160 / mol CuSO4 1 * g CuSO4 654/0
3- حال بايد ببينيم اين مقدار گرم آب برابر چند مول آب مي باشد. براي اين منظور به اين ترتيب عمل مي كنيم:يعني بايد جرم مورد نظر را در معكوس جرم مولي آب ضرب نماييم. جرم مولي نيز با جمع جرم اتمهاي تشكيل دهنده با در نظر گرفتن تعداد آن ها بدست مي آيد.
= تعداد مول آب بخار شده
Mol 020/0=g H2O 0/18 / mol H2O 1 * g H2O 369/0
4- حال نسبت تعداد مول هاي آب بخار شده به مول هاي نمك بي آب را به وسيله تقسيم آن ها به يكديگر بدست مي آوريم.
1/5 = mol 400/0 / mol 020/0 = تعداد مول CuSO4 / تعداد مول H2O
پس نسبت آب به نمك برابر 5 به 1 است. بنابراين فرمول تجربي اين نمك CuSO4.5H2O بوده، تعداد آب تبلور آن 5 است.
منبع: تبيان
دانستنیهای شیمیمعدنی
۱الف) در باره سختی جامدهای یونی می توان سه قاعده زیر موسوم به قاعده Fajans را بیان کرد:
1) در جامدهای یونی با ساختار بلوری یکسان و بار برابر، هر چه فاصله بین یونها کمتر باشد، بر میزان سختی بلور افزوده میشود.
2) در جامدهای یونی که ساختار یکسان و فاصله بینیونی نزدیک دارند، با افزایش بار آنیون و کاتیون، سختی بلور افزایش مییابد.
3) چنانچه یونها در یک جامد یونی دارای آرایش گاز بیاثر باشند، نسبت به جامدهای یونی دیگر که در آنها یونها آرایش گاز بیاثر ندارند، (در صورتی که بار، فاصله بینیونی و ساختار بلور یکسان باشند.) سختی بلور بیشتر است.
۲الف) سیتریک اسید، سدیم کربنات، جوش شیرین (سدیم بیکربنات)، سولفوریک اسید، دی اکسید کربن، هیدروژن پراکسید، آمونیوم پرکلرات، پتاسیم یدید، الکلها و... به عنوان سوخت شیمیایی خودروهای کوچک استفاده میشوند.
چند واکنش از این دست عبارتند از:
2 HOOH --> 2 H2O + O2 enzyme: catalyses
H2CO3 --> CO2 + H2O enzyme: carbonic anhydride
در واکنشهای بالا که با استفاده از آنزیم انجامپذیرند، از انرژی به دست آمده از شکستن پیوند استفاده میشود.
سوختن اتانول:
C2H5OH + 3 O2 --> 2 CO2 + 3 H2O
تجزیه اسید استیک:
CH3CO2H --> CO2 + CH4
یا تجزیه جوش شیرین:
2 NaHCO3 --> Na2CO3 + CO2 + H2O
دو واکنش اخیر برای شروع به گرما نیاز دارند اما پس از شروع واکنش، گرماده هستند.
۳الف) کلرید آهنIII یا FeCl3، مادهای به شدت سمی، خورنده و اسیدی با رنگ متغیر است که رنگ آن به زاویه دید بستگی دارد و از سبز تیره تا بنفش تغییر میکند. انحلال آن در آب گرمازا ست و در اثر انحلال، محلول قهوهای رنگ و اسیدی میدهد. در اثر گرما، به کلرید آهنII و گاز سمی کلر تجزیه میشود:
FeCl3 + Q --> FeCl2 + 1/2 Cl2
با ترکیب FeCl3، جوش شیرین و آب در یک بطری میتوان گازی فوقالعادهای تولید کرد که سبب میشود بطری نوشابه را مانند موشک پرتاب کند.
یادآوری میشود هر ماده منفجره به دو جزء ماده سوختنی و اکسنده نیاز دارد. برای مثال پتاسیم نیترات به شدت اکسنده است ولی به تنهایی منفجر نمیشود. اما ترکیب چهار به شش شکر (به عنوان ماده سوختنی) و پتاسیم نیترات به یک بمب دودزا منتهی میشود.
۴الف) فسفید فلزهایی مانند آلومینیوم، روی، کلسیم و منیزیم به عنوان یک گونه از سمهای دفع آفات، حشرات و جوندهها از دیرباز در بسیاری از کشورهای دنیا به کار میرفتهاند که قیمت ارزان، کاربرد آسان و کارآیی بالا موجب مصرف گسترده آنها در کشاورزی شده است.
در ایران "فسفید آلومینیم" با نام قرص برنج به ویژه در شمال کشور برای نگهداری برنج در انبارها و جلوگیری از تخریب آن توسط حشرهها از سالیان گذشته استفاده میشده است.
قرصهای برنج در تماس با رطوبت موجود در برنج و غلات دیگر، گاز سمی فسفین آزاد میکنند که این گاز موجب نابودی آفات و حشرهها و ماندگاری محصول در انبار میشود. به علت فراریت و نیمه عمر کوتاه گاز فسفین در محیط، مصرف برنج و دیگر فراوردههای کشاورزی نگهداریشده توسط این ماده، پیامدهای سوء در انسان ندارد.
البته فسفید آلومینیوم جزو سمهای کشنده برای انسان است و مقدار کشنده آن برای انسان بالغ با میانگین وزن 70 کگ حدود 500 میلیگرم برآورد شده، این در حالی است که هر قرص برنج حاوی یک گرم فسفید آلومینیوم است. فسفید آلومینیوم در معده در اثر واکنش با آب و اسید معده گاز سمی فسفین آزاد میکند و نشانههای مسمومیت شامل طیف وسیعی از آشفتگیهای گوارشی، قلبی عروقی، کلیوی، کبدی، عصبی و تنفسی است که میتوان استفراغ ، درد ناحیه شکم، سرگیجه، کاهش هوشیاری، کاهش فشار خون، بینظمی تپش قلب، زردی، تشنج و بیهوشی را نام برد.
توضیح بیشتر درباره سمپاشی: دوره کارنس به زبان ساده عبارت است از مدت زمانی که پس از سمپاشی باید طی شود تا فراورده کشاورزی را بتوان مصرف کرد. مسلما پس از سمپاشی نه تنها بافتهای بیرونی گیاه و میوهها به سم آغشته میگردند بلکه پارهای از سمها از طریق روزنههای گیاه یا آوندهای چوبی و آبکش به بافتهای درونی نفوذ و به همه نقاط گیاه سرایت میکنند که مصرف چنین فراوردهای برای بدن زیانآور است.
۵الف) پتاسیم نیترات KNO3 یک ترکیب یونی به رنگ سفید و در آب محلول است. پتاسیم نیترات کاربردهای فراوان دارد که از جمله برای ساختن باروت و نیز در ترکیب خمیر دندان به کار میرود. واكنش انفجار باروت سیاه را میتوان به این صورت نوشت:
4 KNO3 + S + 4 C -> 2 N2 (g) + 2 K2O + 4 CO2 (g) + SO2 (g)
برخی واكنش انفجار باروت را در فضای محدود به صورت زیر نوشتهاند:
2 KNO3 + S + 3 C -> N2 + 3 CO2 + K2S
هنگام انفجار دودی خارج میشود كه مربوط به ایجاد پتاسیم سولفید است.
اگر در هوای آزاد باروت را بسوزانیم معادله واكنش چنین است:
4 KNO3 + 3 S + 2 C -> 2 N2 + 2 K2CO3 + 3 SO2
در عمل برای ساخت باروت سیاه 75 درصد پتاسیم نیترات، 14 درصد زغال چوب و 11 درصد گوگرد به كار میرود. پتاسیم نیترات (شوره) همان ماده سفید رنگی است كه به طور طبیعی در كنار دیوارهای مرطوب ایجاد میشود.
پتاسیم نیترات همچنین به عنوان یک ماده اکسنده نیز کاربرد دارد.








 باسلام
باسلام