شیمیدانهایی که در قرن نوزدهم در کشف پدیدههای مهم شیمی نقش بسزایی ایفا کردهاند
داوی :
در سال 1800 با استفاده از سیل ولتا ، پدیده الکترولیز را کشف و با ارائه نظریه الکترو شیمیایی خود خاصیت الکتریکی مواد و ماهیت پیوند شیمیایی را که بر اساس نظریه اتمی دالتون معین شده بود مشخص کرد و با الکترولیز قلیایی ، فلزات قلیایی را تهیه کرد که سود و پتاس عنصر نیستند بلکه سدیم و پتاسیم جزو عنصرها بوده ، سود و پتاس موادی مرکباند.
دالتون :
قانون نسبتهای چندتایی را کشف کرد. در سال 1807 نظریه اتمی معروف خود را ارائه داد. با وضع نشانههای شیمیایی برای عناصر و تعیین فرمول شیمیایی برای ترکیبهای آنها ، جرم نسبی اتمها را معین کرد «تعیین جرم نسبی اتم).
آووگادرو :
در سال 1811 فرضیه مولکولی را درباره گازها بیان کرد.
برزلیوس :
در سال 1813 نشانههای شیمیایی جدید برای عناصر و فرمول نویسی را در شیمی به سبک امروزی متداول کرد و پدیده ایزومری را کشف کرد.
مندلیف :
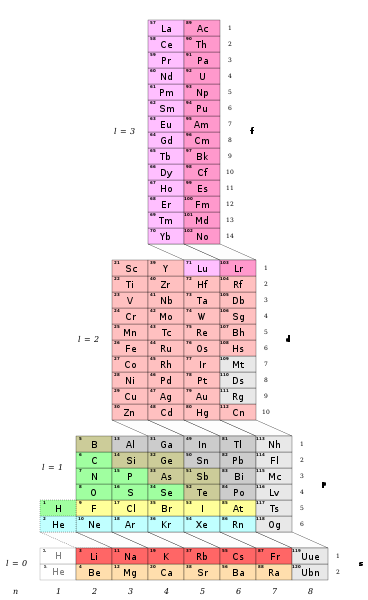
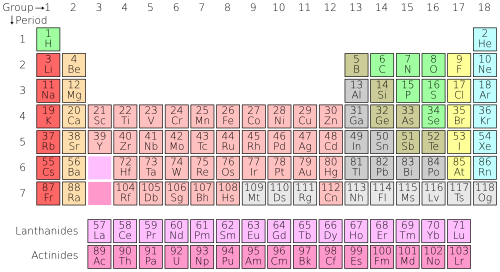
بین سالهای 1869 تا 1871 جدول تناوبی عناصر را تنظیم کرد و تحولی در آموزش شیمی عمومی بوجود آورد.
آرنیوس :
در سال 1888 نظریه معروف تفکیک یونی الکترولیتها را بیان داشت و بر اساس آن مکانیسم رسانایی الکترولیتی و الکترولیز را روشن ساخت.
ورنر :
در سال 1888 نظریه مهم کوتوردیناسیون را در مورد توجیه چگونگی تشکیل ترکیبات کمپلکس ارائه داد.
بکرل ، ماری کوری و پیرکوری :
بین سالهای 1896 تا 1898 پدیده رادیواکتیوی طبیعی و چند عنصر رادیواکتیو را کشف کردند.
پلانک و اینیشتن:
در سالهای 1900 تا 1905 نظریه کوآنتومی تابشهای الکترو مغناطیسی را برای توجیه نمودار توزیع انرژی تابش جسم سیاه و مشاهدات مربوط به پدیده فوتوالکتریک ارائه دادند.
رادفورد :
در سال 1911 ضمن شناسایی ماهیت پرتوهای رادیواکتیو و بمباران ورقههای نازک فلزی توسط ذرات آلفا ، وجود هسته را در درون اتم کشف و مدل منظومه شمسی ـ مانند را برای ساختار اتم پیشنهاد کرد.
سودی :
در سال 1913 با بررسی روی محصولات حاصل از واپاشی رادیواکتیوی اورانیم و توریم ، اولین بار پدیده ایزوتوپی را در مورد سرب کشف کرد.
بوهر :
در سال 1913 بر اساس نظریه پلانک و انیشتن ، خطی بودن طیف نشری اتم هیدروژن و نظریه معروف اتمی خود را درباره ساختمان الکترونی اتم با استفاده از نظریه رادرفورد ارائه داد.
لویس :
در سال 1916 نظر داد آخرین لایه اتم گازهای بیاثر دارای 8 الکترون و بسیار پایدار است و عناصر تمایل دارند ضمن شرکت در واکنشهای شیمیایی لایه ظرفیت خود را به چنین آرایش پایداری برسانند ( قاعده هشتتایی لویس ).
کاسل :
در سال 1916 نظریه پیوند یونی را در مورد تشکیل مواد الکترولیت پیشنهاد کرد.
لویس و لانگمیر :
در سال 1919 پیوند کووالانسی بین اتمها را کشف کردند.
رادرفورد :
در سال 1919 با بمباران هستهای سبک توسط ذره آلفا اولین واکنش هستهای مصنوعی را به مرحله اجرا در آورد و وجود پروتون در هسته اتم را کشف کرد.
سیر گویک و لووری :
در سال 1923 دریافته بودن که پیوند کووالانسی بین اتمها به طریقی که امروزه «داتیو» نامیده میشود نیز تشکیل میشود و تشخیص داد که ماهیت پیوند لیگاندها و اتم مرکزی در ترکیبات کمپلکس از این نوع است.
دوپروی :
در سال 1924 خصلت دوگانگی ( موج ـ ذرهای ) را برای الکترون پیشنهاد کرد.
اولنبک و گوادشمیت :
در سال 1925 با بررسی نتایج آزمایش اشترن گرلاخ درباره انحراف بخار نقره در میدان مغناطیسی ، بوجود حرکت اسپینی الکترون در اتم پی بردند.
هایزنبرگ :
در سال 1927 اصل عدم قطعیت را در مورد اندازه گیری دقیق و همزمان سرعت و مکان الکترون در اتم اعلام کرد.
شرودینگر :
در سال 1926 بر اساس نظریه دوبروی ، اصول مکانیک کوانتومی موجی اتم و معادله تابع موج الکترون و اوربیتالهای اتمی را به منظور حل مسائل مربوط به آرایش الکترونی ، انرژی الکترون در ترازهای مختلف انرژی اطراف هسته و تشکیل پیوند بین اتمها ارائه داد.
هایتلر و لانون :
در سال 1927 نظریه پیوند ظرفیت را براساس مدل موجی اتم ارائه دادند.
پائولنیگ :
در سال 1931 جهت تطبیق ساختار مولکولهایی که پیوند دوگانه دارند با خواص آنها ، نظریه رزونانس مولکولی را ارائه داد و مفهوم الکترونگاتیوی اتم را در شیمی وارد کرد.
مولیکن :
در سال 1932 نظریه اوربیتال مولکولی را درباره چگونگی تشکیل پیوند کووالانسی بین اتمها بر اساس طول مدل موجی اتم ارائه داد.
چادویک :
در سال 1932 از طریق انجام واکنش های هستهای ، وجود نوترون را در هسته اتم کشف کرد.
قلرو و پترازاک :
در سال 1939 «شکافت» هسته اورانیم 235 را کشف کردند.
بت :
در سال 1938 «گداخت هستهای» بین اتمهای سبکی چون کربن و نیتروژن را کشف کرد.
سالپتر :
در سال 1952 «گداخت هستهای» بین اتمهای هیدروژن را کشف کرد.
(اندرسن) و بنبریج :
از طریق واکنشهای هستهای جیوه را به طلا تبدیل کنند.
ادوارد تلر :
در سال 1952 بمب هیدروژنی را بر اساس گداخت هستههای هیدروژن ساخت.
منبع : داشنامه رشد
 فشار گاز ایدهآل در قبل از فرآیند
فشار گاز ایدهآل در قبل از فرآیند
 حجم گاز ایدهآل در قبل از فرآیند
حجم گاز ایدهآل در قبل از فرآیند
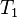 دمای گاز ایدهآل در قبل از فرآیند
دمای گاز ایدهآل در قبل از فرآیند
 فشار گاز ایدهآل در بعد از فرآیند
فشار گاز ایدهآل در بعد از فرآیند
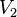 حجم گاز ایدهآل در بعد از فرآیند
حجم گاز ایدهآل در بعد از فرآیند
 دمای گاز ایدهآل در بعد از فرآیند
دمای گاز ایدهآل در بعد از فرآیند
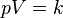
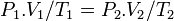
 or
or 
 فشار هر جز است.
فشار هر جز است.
 نسبت مولی است.
نسبت مولی است.
 غلظت جز iام بر حسب ppm (ذره بر میلیون)است.
غلظت جز iام بر حسب ppm (ذره بر میلیون)است.


 فشار هر جز است
فشار هر جز است
 نسبت جز مولی است
نسبت جز مولی است از فرمول زیر بدست میآید
از فرمول زیر بدست میآید ,
, پتانسیل شیمایی جز i است.
پتانسیل شیمایی جز i است.

 فاگوسیته جز شیمیایی
فاگوسیته جز شیمیایی 































.JPG)



 باسلام
باسلام