شماتيك فضايي از بلورهاي جامد
براي دانلود از لينك زير استفاده كنيد.
براي دانلود از لينك زير استفاده كنيد.
این علم در اول بدست زمینشناسان در شناسایی کانیها توسعه یافت سپس شیمیدانان این علم را برای شناسایی مواد بکار گرفتند. پس از آن فیزیکدانان با بکار گیری پراش اشعه ایکس به پیشبرد آن کمک کردند.
در بیشتر کشورها به ویژه در آلمان، بلورشناسی بخشی از کانیشناسی است ولی در کشورهایی مانند انگلستان و ایالات متحده غالبآ به صورت بخشی از فیزیک یا شیمی تدریس میشود.
اکثر کشورها یک کمیتهٔ ملی بلورشناسی دارند که نمایندهٔ اتحادیهٔ بینالمللی بلورشناسی است. این اتحادیه گاهنامهٔ آکتا کریستالوگرافیکا (یادداشتهای بلورشناختی) و جدولهای بینالمللی بلورشناسی را منتشر میکند.



پیوند دلتا δ bonds گونهای پیوند کووالانسی است که در آن چهار کَپَل یک اوربیتال با چهار کَپَل اوربیتالی دیگر همپوشانی میکنند.این پیوند را ازینرودلتا مینامند که از اوربیتالهای d شکل میگیرد.
این پیوند معمولاً در گونههای شیمی آلی فلزی (ترکیبی که دستکم یک پیوند کربن-فلز دارد) دیده میشود.
نمایش پیوند π پای Pi-Bond

پیوند پی (به انگلیسی: π bonds) گونهای پیوند کووالانسی است که در آن دو کَپَل یک اوربیتال با دو کپل اوربیتالی دیگر همپوشانی میکنند. این پیوند را ازینرو پی مینامند که از اوربیتالهای p شکل میگیرد.
N-butyllithium-tetramer
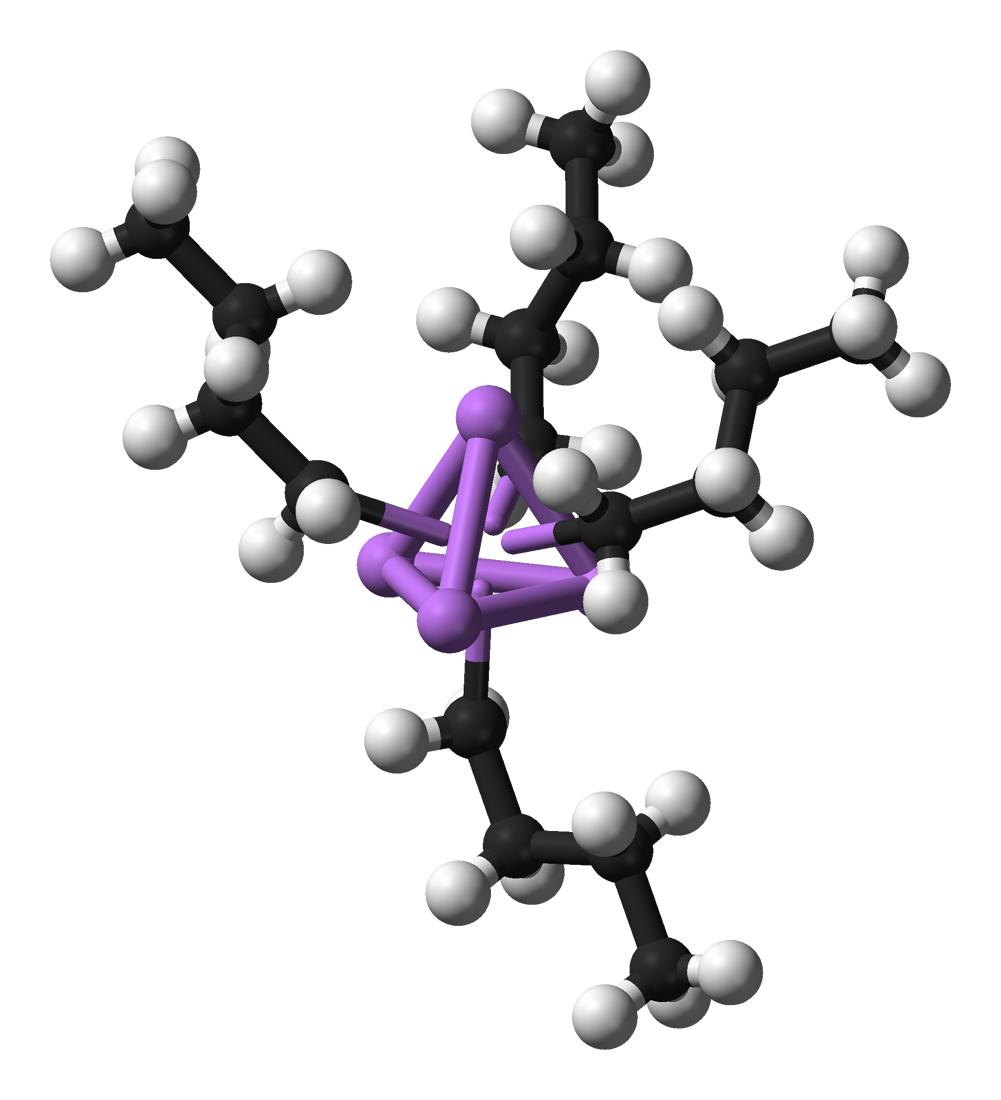
n-Butyllithium hexamer
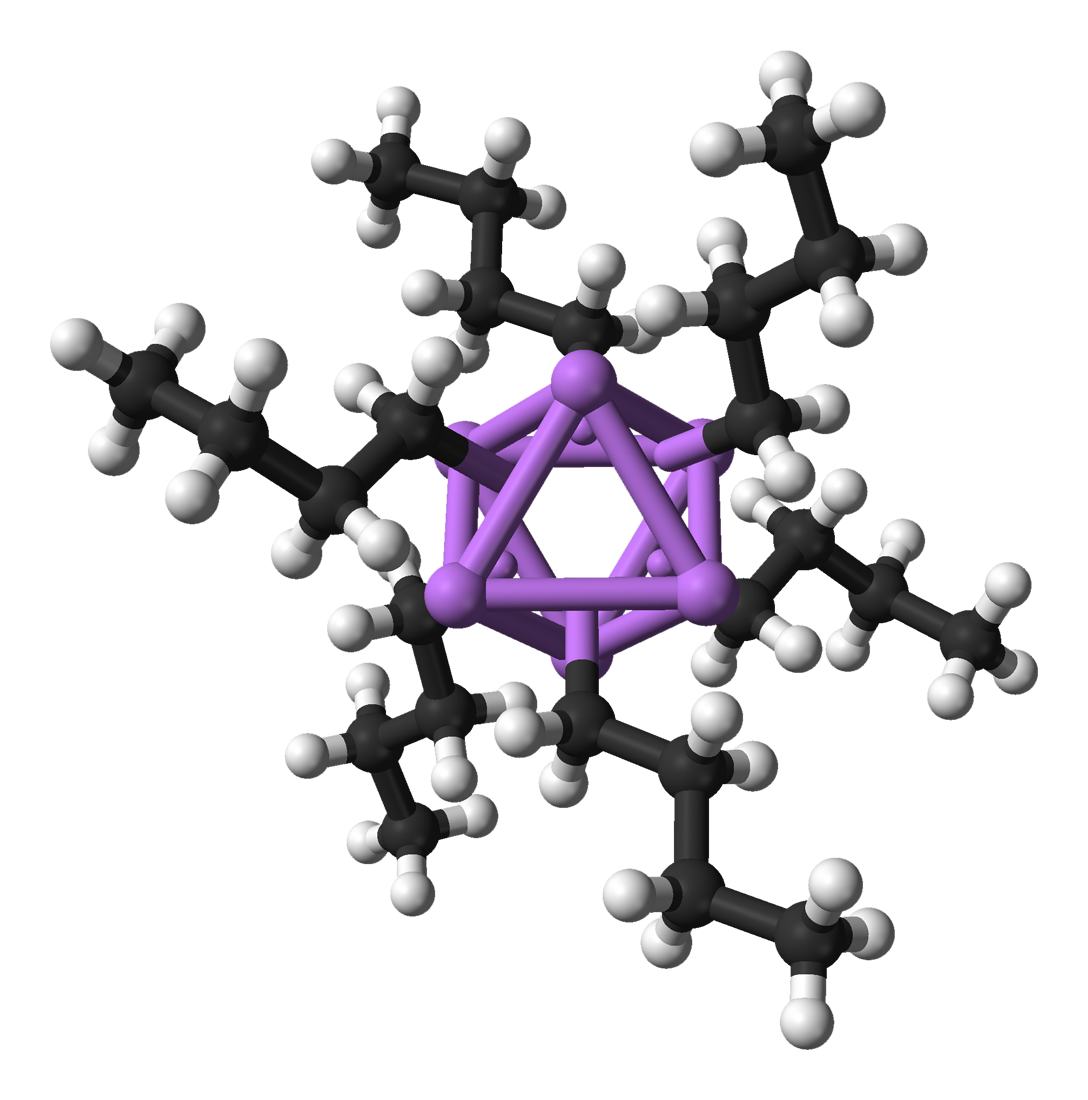
:::::::::سایز واقعی در ادامه مطب::::...



امروز برنامه ارائه دروس کارشناسی ارشد رو براتون گذاشتم. این برنامه در واقع برنامه 4 ترمه کارشناسی ارشد شیمی (آلی – تجزیه – معدنی – شیمی فیزیک) هست. این برنامه ها مربوط به دانشگاه پیام نوره ولی برنامه دانشگاه های دیگه هم تفاوتی با این برنامه نداره.
امیدوارم بدردتون بخوره
برنامه ارائه دروس ارشد شیمی آلی ( 50 کیلوبایت) دانلود
برنامه ارائه دروس ارشد شیمی تجزیه ( 50 کیلوبایت) دانلود
برنامه ارائه دروس ارشد شیمی معدنی ( 50 کیلوبایت) دانلود
برنامه ارائه دروس ارشد شیمی فیزیک ( 50 کیلوبایت) دانلود
نیتروژن مولکولی در طبیعت از دو اتم نیتروژن با یک پیوند سه تایی ساخته شده است. پیوند سه تایی یکی از پایدارترین پیوندهای شیمیایی است که وجود دارد.
این محققان برای شکستن پیوندهای نیتروژن از فلز هافنیم استفاده کردند. در مرحله اول، این فلز سنگین به دور دو اتم نیتروژن می چرخد. فلز با نیتروژن واکنش می دهد و دو پیوند از سه پیوند نیتروژن را می شکند و یک مولکول 'هافنیم نیتروژن' را می سازد.
در این مرحله منواکسید کربن (که پیوند بسیار پایداری دارد) به ترکیب افزوده می شود و با این مولکول جدید واکنش می دهد. به این ترتیب آخرین پیوند نیتروژن را هم می شکند. مولکولی که از واکنش میان کربن و نیتروژن تشکیل می شود 'اکسامید' نام دارد که زمانی که اسید اضافه می شود فلز هافنیم را آزاد می کند.
براساس گزارش ساینس مگزین، ترکیبات نیتروژن و کربن در صنایع دارویی و ساخت نایلون کاربردهای بسیاری دارند اما به دلیل پایداری بالا تشکیل آنها نیازمند صرف هزینه و انرژی بسیار زیادی است. اکنون با این روش جدید می توان تاحد قابل ملاحظه ای در این هزینه ها صرفه جویی کرد.
نام آزمایش اول : تهیه کمپلکس کربوناتو تترا آمین کبالت(III) نیترات
نام آزمایش دوم : تهیه کمپلکس کلرو پنتا آمین کبالت(III) کلراید
نام آزمایش سوم : تهیه کمپلکس های نیترو و نیتریتو پنتا آمین کبالت(III) کلراید
تهیه کمپلکس کربوناتو تترا آمین کبالت(III) نیترات
CO3(NH4)2 + Co(NO3)2 + NH3 + H2O2 → [Co(NH3)4CO3]NO3 + NH4OH + H2O
شرح آزمایش: 6.7 گرم کربنات آمونیوم را در 20 میلی لیتر آب مقطر حل کرده و به آن 20 میلی لیتر محلول آمونیاک غلیظ افزوده و حاصل را در حالی که هم می زنیم در محلولی از 5 گرم کبالت (II) نیترات در 15 میلی لیتر آب خالی می کنیم.
آنگاه 3 میلی لیتر آب اکسیژنه 30 درصد را به آرامی به آن بیفزایید و محلول بدست آمده را در یک بشر ریخته و در داخل هود روی شعله گاز 30 – 35 میلی لیتر تغلیظ می کنیم ( مواظب باشید که محلول نجوشد ) ضمن تبخیر 1.5 گرم آمونیوم کربنات را به آن اضافه می کنیم و حاصل را صاف می کنیم و محلول داغ صاف شده را در حمام آب یخ سرد می کنیم تا بلورهای قرمز کمپلکس تشکیل گردد. بلورها را به کمک صافی صاف می کنیم و آنها را با چند میلی لیتر آب و سپس اتانول شستشو می دهیم.
تهیه کمپلکس کلرو پنتا آمین کبالت(III) کلراید
[Co(NH3)4CO3]+ + 2HCl → [Co(NH3)4(OH2)Cl]+2 +CO2 + Cl-
[Co(NH3)4(OH2)Cl]+2 + NH3 → [Co(NH3)5(OH2)]3+ + Cl-
[Co(NH3)5(OH2)]3+ 3HCl → [Co(NH3)5Cl]Cl2 + H2O + 3H+
شرح آزمایش : 3 گرم کربوناتو تترا آمین کبالت() نیترات تهیه شده در آزمایش قبل را در 30 میلی لیتر آب حل کرده و تا خرج شدن گاز دی اکسید کربن از محلول غلیظ HCl به آن اضافه می کنیم. آنگاه محلول را با آمونیاک غلیظ خنثی و در حدود 3 میلی لیتر بیشتر از مقدار لازم آمونیاک به آن اضافه می کنیم .
حاصل را برای 20 دقیقه گرم می کنیم ( مواظب باشید محلول نجوشد ) در این مرحله کمپلکس مورد نظر تشکیل می شود و حال محلول را کمی سرد کرده و 45 میلی لیتر اسید کلریدریک غلیظ به آن اضافه می کنیم . آن را مجدداً 20 -30 دقیقه حرارت داده و تغییر رنگ محلول را مشاهده می کنیم. با سرد کردن محلول در دمای اتاق بلورهای قرمز ارغوانی تشکیل می شوند. بلورها را با مقداری آب مقطر یخی شستشو داده و با استفاده از پمپ تخلیه و قیف بوخنر صاف می کنیم و سپس با چند میلی لیتر اتانول می شوییم و در داخل آون 120 درجه سانتی گرادی برای خارج ساختن حلال مواد حاصل را خشک می کنیم.
سؤالات :
1: راندمان محصول: 1.123 گرم کمپلکس بدست آمده
2: معادله واکنش و موازنه آن:
2CO3(NH4)2+2Co(NO3)2+8NH3+ H2O2→2[Co(NH3)4CO3]NO3+4NH4++2NO3-+2OH-
3: مگانیسم واکنش از نوع تبادلی – تفکیکی است
4: برای اندازه گیری درصد Cl موجوددر کمپلکس کلروپنتاآمین کبالت (III) کلراید چه روشی را پیشنهاد می نمایید؟
کلرهای بخش خارج از کئوردیناسیون را می توان با تیتراسیون با نیترات نقره اندازه گیری کردو کلر داخلی می توان با آکواسیون خارج کرده و در مرحله بعد بوسیله AgNO3 تیتر و اندازه گیری کرد.
5: روشی برای سنجش مقدار آمونیاک و کبالت موجود در کربوناتو تتراآمین کبالت(III) نیترات ارائه نمایید؟
آمونیاک را با تیتراسیون اسید و باز و کبالت را با جذب سنجی و به علت اینکه کمپلکس رنگی می باشد ، اندازه گیری می کنیم.
6: میزان هدایت الکتریکی یک محلول آبی از کمپلکس کلرو پنتاآمین کبالت(III) کلراید در اثر گذشت زمان تغییر می کند چگونگی این تغییر را توضیح دهید؟
با گذشت زمان کلر داخلی با آب جانشین شده و تعداد یون افزایش یافته و بنابراین هدایت محلول افزایش پیدا می کند.
7: تأ ثیر اسید های رقیق و غلیظ بر وی کمپلکس اولی را بنویسید؟
در حضور اسی های رقیق به علت اینکه H+ کمتر است آب جایگزین می شود ولی در حضور اسیدهای غلیظ به علت بیشتر بودن H+ یون اگزونیم تشکیل می شود و کندن پان آسان است و یون Cl جایگزین می شود.
8: کمپلکس کربوناتو تترا آمین را ابتدا در اسید رقیق حل نموده و سپس آمونیاک گرم و رقیق را به آن می افزاییم محصول بدست آمده چیست؟ و اگر این واکنش در حضور کربن فعال انجام شود نتیجه چه خواهد بود؟
در حضور اسید رقیق آکوا پنتاآمین کبالت تشکیل می شودو کربن فعال نقش کاتالیزور و جذب سطحی کننده را داردو سرعت واکنش را افزایش می دهدو [Co(NH3)6] را تشکیل می دهد.
تهیه کمپلکس نیترو و نیتریتو پنتا آمین کبالت(III) کلراید
یکی از انواع ایزومریزاسیون در کمپلکسها، ایزومریزاسیون ناشی از نحوه اتصال لیگاند می باشد که از موارد شناخته شده آن نیترو و نیتریتو پنتاآمین کبالت (III) کلراید هستند.
در نوع نیترو اتصال بین کبالت و گروه NO2 از طریق N و در نوع نیتریتو اتصال از طریق O می باشد. رنگ کمپلکس نیترو زرد رنگ و رنگ کمپلکس نیتریتو قرمز می باشد.
فرم قرمز یعنی نیتریتو نا پایدار تر از نیترو می باشد و به آهستگی و در طول زمان و در اثر حرارت خیلی سریع به فرم زرد یعنی نیترو تبدیل می شود.
شرح آزمایش : مخلوطی از یک گرم کلرو پنتا آمین کبالت(III) کلراید و 10 میلی لیتر آب مقطر و 2.5 میلی لیتر از آمونیاک 10 درصد را در بشری به حجم 100 سی سی ریخته و روی یک حمام بخار حرارت می دهیم. تا همگی حل گردد.( باید محلول را مرتب تکان داده و روی محلول یک شیشه ساعت گذاشت) محلول را صاف کرده و محلول زیر صافی را جدا نموده و سرد می کنیم و بوسیله اسید کلریدریک رقیق 2 مولار محیط را تا pH=4 اسیدی می کنیم.
آنگاه 1.25 گرم از بلور نیتریت سدیم را به آن اضافه می کنیم و در حمام بخار گرم به گرم کردن آن ادامه می دهیم
تا اینکه رسوب قرمز رنگ کاملاً حل شود. محلول زرد قهوه ای را سرد کرده و در حالی که به هم می زنیم به آرامی 12 میلی لیتر اسید کلریدریک غلیظ به آن اضافه می کنیم. سپس در حمام یخ سرد نموده و کریستالهای زرد قهوه ای را صاف نموده و صافی را با HCl 1:1 شسته و آنگاه با الکل تا آزاد شدن کامل اسید آن را می شوییم و در هوا خشک می کنیم.
مخلوطی از یک 0.5 کلرو پنتا آمین کبالت(III) کلراید و 7.5 میلی لیتر آب مقطر و 1.25میلی لیتر از آمونیاک 10 درصد را در بشری به حجم 100 سی سی ریخته و روی یک حمام بخار حرارت می دهیم.
محلول را صاف کرده و محلول زیر صافی را جدا نموده و سرد می کنیم و بوسیله اسید کلریدریک رقیق 2 مولار محیط را تا pH=7 می رسانیم.
آنگاه 1.25 گرم از بلور نیتریت سدیم را به آن اضافه می کنیم و پس از حل شدن آن 0.5 میلی لیتر اسید کلریدریک 1:1 به آن اضافه می کنیم و پس از سرد کردن محلول رسوب حاصله را صاف کرده و باآب سرد و الکل می شوییم.
نقش الکل که در اواخر واکنش اضافه می شود چیست؟
خلوص ماده را بالا می برد
قدرت حلالیت زیاد برای ناخالصی ها
ثابت دی الکتریک را بالا می برد
اضافه کردن NH3 زیادی چه دلیلی دارد؟
زیاد ریختن آمونیاک به دلیل این است که NH3 در محیط با چیزی جایگزین نشود.
Symmetry in Chemistry
جزوه ای کامل و فوق العاده در مورد تقارن شامل مباحث تقارن،گروه های نقطه ای،جدول های کاراکتر و ... همراه با آموزش صوتی.
|
نام اوربیتال |
شکل اوربیتال |
نام اوربیتال |
شکل اوربیتال |
|
1s
|
|
3py |
|
|
2s |
|
3pz
|
|
|
3s
|
|
3dxy
|
|
|
2px |
|
3dxz
|
|
|
2py
|
|
3dyz
|
|
|
2pz
|
|
3dz2 |
|
|
3px
|
|
3dx2-y2
|
|
هیدروژن ساده ترین عنصر شناخته شده برای انسان است؛ هر اتم هیدروژن تنها یك پروتون و یك نوترون دارد. هیدروژن فراوانترین گاز هستی است. ستاره ها در ابتدا از هیدروژن ساخته شده بودند. انرژی خورشید از هیدروژن به دست می آید. هیدروژن توپ عظیمی از گازهای هیدروژن و هلیوم است. درون خورشید، اتمهای هیدروژن تركیب می شود و اتمهای هلیوم را پدید می آورد. این پدیده گدازه « Pusiun » انرژی پرتوهای خورشید را تولید می كند.
انرژی پرتوی خورشید باعث برقراری حیات روی زمین است. این انرژی به ما نور می دهد، باعث رشد گیاهان می شود، بادها را به جریان می اندازد، باعث بارش باران می شود. این انرژی در سوختهای فسیلی ذخیره شده است. بیشتر انرژی مصرفی ما در حال حاضر از خورشید منشأ می گیرد. هیدروزن گازی (H2) روی زمین وجود ندارد. این عنصر همیشه به....
۱الف) در باره سختی جامدهای یونی می توان سه قاعده زیر موسوم به قاعده Fajans را بیان کرد:
1) در جامدهای یونی با ساختار بلوری یکسان و بار برابر، هر چه فاصله بین یونها کمتر باشد، بر میزان سختی بلور افزوده میشود.
2) در جامدهای یونی که ساختار یکسان و فاصله بینیونی نزدیک دارند، با افزایش بار آنیون و کاتیون، سختی بلور افزایش مییابد.
3) چنانچه یونها در یک جامد یونی دارای آرایش گاز بیاثر باشند، نسبت به جامدهای یونی دیگر که در آنها یونها آرایش گاز بیاثر ندارند، (در صورتی که بار، فاصله بینیونی و ساختار بلور یکسان باشند.) سختی بلور بیشتر است.
۲الف) سیتریک اسید، سدیم کربنات، جوش شیرین (سدیم بیکربنات)، سولفوریک اسید، دی اکسید کربن، هیدروژن پراکسید، آمونیوم پرکلرات، پتاسیم یدید، الکلها و... به عنوان سوخت شیمیایی خودروهای کوچک استفاده میشوند.
چند واکنش از این دست عبارتند از:
2 HOOH --> 2 H2O + O2 enzyme: catalyses
H2CO3 --> CO2 + H2O enzyme: carbonic anhydride
در واکنشهای بالا که با استفاده از آنزیم انجامپذیرند، از انرژی به دست آمده از شکستن پیوند استفاده میشود.
سوختن اتانول:
C2H5OH + 3 O2 --> 2 CO2 + 3 H2O
تجزیه اسید استیک:
CH3CO2H --> CO2 + CH4
یا تجزیه جوش شیرین:
2 NaHCO3 --> Na2CO3 + CO2 + H2O
دو واکنش اخیر برای شروع به گرما نیاز دارند اما پس از شروع واکنش، گرماده هستند.
۳الف) کلرید آهنIII یا FeCl3، مادهای به شدت سمی، خورنده و اسیدی با رنگ متغیر است که رنگ آن به زاویه دید بستگی دارد و از سبز تیره تا بنفش تغییر میکند. انحلال آن در آب گرمازا ست و در اثر انحلال، محلول قهوهای رنگ و اسیدی میدهد. در اثر گرما، به کلرید آهنII و گاز سمی کلر تجزیه میشود:
FeCl3 + Q --> FeCl2 + 1/2 Cl2
با ترکیب FeCl3، جوش شیرین و آب در یک بطری میتوان گازی فوقالعادهای تولید کرد که سبب میشود بطری نوشابه را مانند موشک پرتاب کند.
یادآوری میشود هر ماده منفجره به دو جزء ماده سوختنی و اکسنده نیاز دارد. برای مثال پتاسیم نیترات به شدت اکسنده است ولی به تنهایی منفجر نمیشود. اما ترکیب چهار به شش شکر (به عنوان ماده سوختنی) و پتاسیم نیترات به یک بمب دودزا منتهی میشود.
۴الف) فسفید فلزهایی مانند آلومینیوم، روی، کلسیم و منیزیم به عنوان یک گونه از سمهای دفع آفات، حشرات و جوندهها از دیرباز در بسیاری از کشورهای دنیا به کار میرفتهاند که قیمت ارزان، کاربرد آسان و کارآیی بالا موجب مصرف گسترده آنها در کشاورزی شده است.
در ایران "فسفید آلومینیم" با نام قرص برنج به ویژه در شمال کشور برای نگهداری برنج در انبارها و جلوگیری از تخریب آن توسط حشرهها از سالیان گذشته استفاده میشده است.
قرصهای برنج در تماس با رطوبت موجود در برنج و غلات دیگر، گاز سمی فسفین آزاد میکنند که این گاز موجب نابودی آفات و حشرهها و ماندگاری محصول در انبار میشود. به علت فراریت و نیمه عمر کوتاه گاز فسفین در محیط، مصرف برنج و دیگر فراوردههای کشاورزی نگهداریشده توسط این ماده، پیامدهای سوء در انسان ندارد.
البته فسفید آلومینیوم جزو سمهای کشنده برای انسان است و مقدار کشنده آن برای انسان بالغ با میانگین وزن 70 کگ حدود 500 میلیگرم برآورد شده، این در حالی است که هر قرص برنج حاوی یک گرم فسفید آلومینیوم است. فسفید آلومینیوم در معده در اثر واکنش با آب و اسید معده گاز سمی فسفین آزاد میکند و نشانههای مسمومیت شامل طیف وسیعی از آشفتگیهای گوارشی، قلبی عروقی، کلیوی، کبدی، عصبی و تنفسی است که میتوان استفراغ ، درد ناحیه شکم، سرگیجه، کاهش هوشیاری، کاهش فشار خون، بینظمی تپش قلب، زردی، تشنج و بیهوشی را نام برد.
توضیح بیشتر درباره سمپاشی: دوره کارنس به زبان ساده عبارت است از مدت زمانی که پس از سمپاشی باید طی شود تا فراورده کشاورزی را بتوان مصرف کرد. مسلما پس از سمپاشی نه تنها بافتهای بیرونی گیاه و میوهها به سم آغشته میگردند بلکه پارهای از سمها از طریق روزنههای گیاه یا آوندهای چوبی و آبکش به بافتهای درونی نفوذ و به همه نقاط گیاه سرایت میکنند که مصرف چنین فراوردهای برای بدن زیانآور است.
۵الف) پتاسیم نیترات KNO3 یک ترکیب یونی به رنگ سفید و در آب محلول است. پتاسیم نیترات کاربردهای فراوان دارد که از جمله برای ساختن باروت و نیز در ترکیب خمیر دندان به کار میرود. واكنش انفجار باروت سیاه را میتوان به این صورت نوشت:
4 KNO3 + S + 4 C -> 2 N2 (g) + 2 K2O + 4 CO2 (g) + SO2 (g)
برخی واكنش انفجار باروت را در فضای محدود به صورت زیر نوشتهاند:
2 KNO3 + S + 3 C -> N2 + 3 CO2 + K2S
هنگام انفجار دودی خارج میشود كه مربوط به ایجاد پتاسیم سولفید است.
اگر در هوای آزاد باروت را بسوزانیم معادله واكنش چنین است:
4 KNO3 + 3 S + 2 C -> 2 N2 + 2 K2CO3 + 3 SO2
در عمل برای ساخت باروت سیاه 75 درصد پتاسیم نیترات، 14 درصد زغال چوب و 11 درصد گوگرد به كار میرود. پتاسیم نیترات (شوره) همان ماده سفید رنگی است كه به طور طبیعی در كنار دیوارهای مرطوب ایجاد میشود.
پتاسیم نیترات همچنین به عنوان یک ماده اکسنده نیز کاربرد دارد.
روش اول
مواد لازم: باریم پراکسید، سولفوریک اسید 20%، باریم کربنات، یخ
روش کار: درون یک ارلن کوچک 25 میلی لیتر سولفوریک اسید 20% ریخته و پس از سرد کردن (ارلن را درون آب یخ قرار دهید) به تدریج 5 گرم BaO2 به آن اضافه کنید (ارلن همچنان درون آب یخ باشد) در این حالت باریم سولفات ته نشین میشود. سپس به آن حدود یک گرم BaCO3 جامد اضافه نموده، رسوب را صاف کنید. محلول زیر صافی آب اکسیژنه میباشد.
روش دوم
مواد لازم: باریم پراکسید، سولفوریک اسید
روش کار: 30 گرم باریم پراکسید را در یک بشر با کمی آب به صورت خمیر در آورید. در یک ارلن 60 میلی لیتر سولفوریک اسید 4 نرمال بریزید و آنرا در یک تشت آب – یخ قرار دهید تا کاملا سرد شود. سپس به تدریج خمیر باریم پر اکسید را به آن اضافه کنید و بهم بزنید. پس از تمام شدن باریم پر اکسید رسوب را صاف کنید. محلول زیر صافی آب اکسیژنه است.
روش سوم
مواد لازم: باریم پراکسید، کپسول گاز CO2
روش کار: 10 گرم باریم پراسید را داخل ارلن در آب یخ به صورت معلق در آورید و به آن مقدار کافی گاز کربن دی اکسید وارد کنید. رسوب را با صاف کردن از آب اکسیژنه جدا کنید.
روش چهارم
مواد لازم: فسفریک اسید، سدیم پراکسید
روش کار: در یک لوله آزمایش مقدار 10 میلی لیتر فسفریک اسید بریزید و آنرا در ظرف آب یخ نگهدارید. پس از سرد شدن به آن مقدار کمی سدیم پراکسید اضافه کنید.
روش پنجم
مواد لازم: سدیم دی هیدروژن ارتو فسفات، سدیم پراکسید، سدیم هیدروکسید، فسفریک اسید، یخ
روش کار: محلولی از 5 گرم سود در 40 میلی لیتر آب مقطر تهیه کنید. به محلول فوق 8 میلی لیتر ارتو فسفریک اسید اضافه کنید. مخلوط را پس از به هم زدن در آب یخ سرد نمائید. این واکنش منجر به سدیم دی هیدروژن فسفات میشود.
2/2 گرم سدیم پر اکسید پودر شده را به محلول سیر شده سدیم دی هیدروژن ارتو فسفات به تدریج ضمن سرد کردن و به هم زدن به وسیله یک میله شیشه ای، اضافه نمایید. (چنانچه درجه حرارت محیط زیاد پایین باشد بلورهای دی سدیم هیدروژن ارتو فسفات 12 آبه با قدری یخ متبلور میشود.)
درجه حرارت محیط را به (1-) درجه سانتیگراد زیر صفر برسانید و رسوب تولید شده را صاف کنید. محلول زیر صافی آب اکسیژنه است.
اسید نیتریک خالص (HNO3) در 41.6- درجه سانتیگراد ذوب شده ، تولید مایع بیرنگی میکند، اما نسبت به درجه حرارت و درجه تابش نور بر آن ، گستره رنگ آن از زرد تا قرمز متمایل به قهوهای متغیر است. این تغییرات نتیجه تجزیه آن طبق واکنش زیر است:
2HNO3 -----> 2NO2 + H2 + 1/2 O2
به این علت ظرفهای محتوی آن ، همیشه تحت فشار کنترل شده میباشد. اسید نیتریک با آب قابل احتراق است و محلول آن آزئوتروپی را تشکیل میدهد که نقطه جوش آن برابر با 121.9 درجه سانتیگراد است که شامل 68.7% وزنی HNO3 میباشد.

روشهای تهیه اسید نیتریک
امروزه در تولید صنعتی اسید نیتریک ، آمونیاک بعنوان ماده اولیه استفاده میشود. از نظر تاریخی ، اسید نیتریک اولین بار از اثر اسید سولفوریک روی نیترات سدیم (شوره شیلی ) بدست آمد. واکنش در کورههایی با دمای 150 تا 170 درجه سانتیگراد صورت میگیرد. اسید بدست آمده ، دارای غلظت 95 تا 97 درصد است.
روش بریک لند ( Brikeland )
در این روش میتوان اسید نیتریک را از اکسید نیتریک مطابق واکنش زیر بدست آورد.
N2 + O2 -----> 2NO + 43Kcal
تبدیل NO به HNO3 با اکسیداسیون و هیدراتاسیون انجام میگیرد. در این فرایند بخاطر کم بودن غلظت NO ، علاوه بر هزینه انرژی الکتریکی ، مقداری گاز نیز باید در جریان باشد. ضمنا دمای بالا نیز باعث واکنش عکس و تجزیه NO میشود.
سنتز اسید نیتریک از آمونیاک
امروزه اسید نیتریک بطور صنعتی از آمونیاک تهیه میشود. برای این کار لازم است که ماده اولیه را با هوا به اکسید نیتروژن تبدیل کرد.
4NH3 + 5O2 -----> 4NO + 6H2 + 216,24Kcal
بنابراین آن را با آرامی به آب اضافه میکنند. این مساله بدلیل پایین بودن دانسیته آب نسبت به اسید سولفوریک میباشد که آب میل دارد روی اسید قرار گیرد. میل ترکیبی اسید سولفوریک با آب بقدری بالاست که میتواند مولکولهای هیدروژن و اکسیژن را از بقیه ترکیبات بصورت آب جدا کند. به عنوان مثال مخلوط کردن گلوکز و اسید سولفوریک ، عنصر کربن و آب ایجاد میکند.
اسید سولفوریک قسمت عمده باران اسیدی میباشد که از آلایندههای جوی مثل حاصل از کارخانهها با آب باران بوجود میآید.
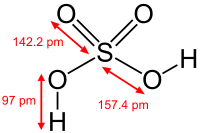
تاریخچه
اسید سولفوریک در قرن نهم توسط شیمیدان ایرانی به نام زکریای رازی کشف شد. او اسید سولفوریک را از طریق تقطیر خشک کانیهایی که شامل سولفات آهن که زاج سبز نامیده میشود و سولفات مس که کات کبود نامیده میشد بدست آورد. حرارت هر یک از این ترکیبات باعث تجزیه آنها و ایجاد اکسید آهن II یا اکسید مس II ، آب و میگردد. ترکیب آب و حاصل شده ، محلول رقیق اسید سولفوریک ایجاد میکند.
این روش با ترجمه متون علمی و کتابهای دانشمندان مسلمان ایرانی توسط شیمیدانهای اروپایی در قرون وسطی مانند آلبرت ماگنوس در اروپا شناخته شد و به این دلیل اسید سولفوریک را شیمیدانهای قرون وسطی به نام جوهر گوگرد شناختند.
در قرن هفدهم ، جان گلوبر ، اسید سولفوریک را از سوزاندن سولفورو نیترات پتاسیم در مجاورت بخار آب تهیه کرد. در سال 1746 ، جان روبک اسید سولفوریک را با غلظت 40-35% در ظروف سربی تولید میکرد. جوزف گیلوساک با اصلاح روش روبک ، اسید سولفوریکی با غلظت 78% بدست آورد.
با این همه صنایع رنگرزی و سایر صنایع شیمیایی خواهان اسید سولفوریک با غلظت بالاتر بودند. در اواسط قرن 18 این امر با روش تقطیر خشک کانیها ، شبیه همان روش اولیه رازی ممکن شد. در این روش سولفید آهن در اثر حرارت در هوا تولید سولفات آهن II میکند و فراورده حاصل با حرارت اضافی اکسید شده و تولید سولفات آهن III میکند که آن هم در اثر حرارت در 480 درجه سانتیگراد تجزیه شده و اکسید آهن و ایجاد میکند. عبور دادن به آرامی از میان آب ، اسید سولفوریک با غلظت بالا ایجاد میکند.
کاربرد اسید سولفوریک
اسید سولفوریک جزء مواد شیمیایی پراستفاده میباشد. این ماده در واکنشهای شیمیایی و فرآیندهای تولید سایر ترکیبات ، کابرد فراوانی دارد. عمدهترین استفاده آن در کارخانههای تولید کود شیمیایی ، استخراج فلزات ، سنتزهای شیمیایی ، تصفیه پسابها و پالایشگاههای نفت میباشد. اسید سولفوریک در اثر واکنش با اسید نیتریک ، یون نیترونیوم تولید میکند که در فرآیند نیترودار کردن ترکیبات استفاده میشود.
فرآیند نیترودار کردن در صنایع تولید مواد منفجره مانند تولید ترینیتروتولوئن (TNT) ، نیترو گلیسیرین و ... استفاده میشود. اسید سولفوریک در انبارههای سربی (باطریهای سربی) به عنوان محلول الکترولیت استفاده میشود.
اسید سولفوریک ، یک عامل آبگیری بسیار قوی است. در اکثر واکنشها به عنوان عامل هیدراتاسیون استفاده میشود و در تولید میوههای خشک هم به میزان کم ، از اسید سولفوریک برای جذب آب استفاده میکنند.
تولید صنعتی اسید سولفوریک به روش تماسی
در سال 1832 یک تاجر انگلیسی سرکه ، روشی اقتصادی برای تولید و اسید سولفوریک غلیظ ابداع کرد که امروزه به نام فرآیند تماسی معروف است و قسمت اعظم اسید سولفوریک در دنیا به این روش تولید میگردد. این فرآیند در سه مرحله صورت میگیرد که عبارتند از :
تهیه و خالص سازی :
خالص سازی و هوا برای جلوگیری از مسمومشدن کاتالیزور لازم است. گازها پس از شستشو با آب ، با اسید سولفوریک خشک میشوند.
اکسیداسیون کاتالیکی به :
با در دمای بالاتر از 450 درجه سانتیگراد و فشار 2atm و کاتالیزور پنتا اکسید وانادیم ، واکنش داده و تولید میکند. تولید شده از میان تبادلگر گرمایی عبور داده شده و در اسید سولفوریک غلیظ حل شده و تولید الئوم میکند. به دلیل اینکه انحلال در آب بسیار گرمازا بوده و بجای اسید سولفوریک مایع ، مه تولید میشود، انحلال مستقیم در آب عملی نمیباشد.
تولید :
اولئوم با آب واکنش داده و اسید سولفوریک تولید میکند.
از واکنش دی اکسيد منگنز با پتاس يا کربنات پتاسيم در مجاورت هوا يا ساير اکسنده ها مانند نيترات پتاسيم, منگنات پتاسيم دست می آيد. منگنات پتاسيم سبز رنگ است که در آب حل شده و با عبور دی اکسيد کربن، کلر يا اوزون از محلول به پرمنگنات تبديل می شود.

رنگ يون پرمنگنات ارغوانی پر رنگ است. بلور پتاسيم پرمنگنات تقريبا سياه رنگ است. در آب محلول و ناپايدار است. درمحيط اسيدی به آرامی تجزيه می شود و در محيط های خنثی و قليايی و در تاريکی تقريبا پايدار است.
تعيين درصد MnO2
4/0 گرم از سنگ معدن و25 میلی لیتر سولفات فروی اسيد سولفوريکی 1/0 نرمال رادر يک ارلن 250 میلی لیتر بريزيد. در ارلن ديگری 250 میلی لیتر سولفات فروی 1/0 نرمال بريزيد. دو ارلن را روی حمام آب گرم به مدت 5/1 ساعت گرم کنيد. به هر يک از ارلن ها 100 میلی لیتر آب جوش اضافه کنيد.
در بورت پرمنگنات پتاسيم 1/0 بريزيد و تيتراسيون را انجام دهيد. اگر مقدار پرمنگنات پتاسيم مصرفی برای سولفات فرو V1 و برای پيروليت V2 باشد. مقدار سولفات فروی مصرفی برای احيای MnO2 به +Mn2 برابر V1-V2 خواهد شد.
5/6 گرم پتاس و 6/5 گرم سنگ معدن را در داخل بوته ريخته و 5 میلی لیتر آب مقطر به آن اضافه کنيد و بهم بزنيد. سپس آنرا در 100 میلی لیتر آب جوش حل کرده و صاف کنيد. محلول سبز رنگ را در دمای 50 تا 60 درجه گرم کرده و گاز CO2 وارد آن کنيد. بعد از 15 دقيقه منگنات به پرمنگنات تبديل می شود. آنرا صاف کنيد تا MnO2 از واکنش خارج شود. می توانید بازده واکنش را محاسبه کنيد.
متبلور کردن پرمنگنات پتاسيم
محلول پرمنگنات پتاسيم را در يک ارلن خلاء ريخته و آنرا به خرطوم آبی وصل کنيد. آنرا گرم کنيد. پس از تبخير آب، آنرا در کريستاليزور بريزيد ودر سرما متبلور شود. جهت بلور سازی يک تکه کوچک بلور پرمنگنات خالص با آن اضافه کنيد. آنگاه بلور را با صافی جدا کرده و با ر خشک کنيد. با توزين بلور، بازده واکنش را محاسبه کنيد.
تعيين درجه خلوص پرمنگنات پتاسيم
۲ گرم پرمنگنات پتاسيم را در آب حل کرده و به حجم 100 میلی لیتر برسانيد. و در بورت 50 میلی لیتر بريزيد. 10 میلی لیتر اکساليک اسيد 1/0 نرمال را در ارلن 250 میلی لیتر ريخته و به آن 20 میلی لیتر اسيد سولفوريک 4 نرمال اضافه کنيد. آنرا گرم کنيد. آنگاه با محلول پرمنگنات داخل بورت تيتر کنيد. نرماليته پرمنگنات و از آن درصد خلوص پرمنگنات را بدست آوريد.
تهيه پرمنگنات پتاسيم به روش الکتروليز
به محلول منگنات پتاسيم (تقريبا 9%) پتاس 5% به آن اضافه کنيد و در طرف الکتروليز بريزيد. يک ورقه آهنی بعنوان آند و يک ميله آهنی که سطح آن يک دهم سطح آند است، بعنوان کاتد انتخاب کنيد. ناحيه کاتدی و آندی را بوسيله ديافراگم استوانه ای جدا کنيد.
دمای الکتروليز 60 درجه، دانسيته جريان آندی 84 آمپر بر فوت مربع، دانسيته جريان کاتدی 840 آمپر بر فوت مربع و افت پتانسيل بر حسب ظرفيت الکتروليز 3 ولت است. با پيشرفت اکسايش، پرمنگنات پتاسيم به صورت بلور درمی آيد و محلول الکتروليز قليايی تر می شود. محلول را سرد کنيد و بلورهای پرمنگنات را طبق روش قبل بدست آورديد.
روش تر(Wet process):
در اثر اضافه کردن اسید سولفوریک روی فسفات کلسیم بدست می آید. طبق واکنش زیر:

در این روش کانیهای فسفات را با اسید سولفوریک ترکیب می کنند، علاوه بر تولید اسید فسفریک و برخی فسفاتها که ترکیبات اصلی هستند، سایر ترکیبات (CACO3CAF2)هم تولید میشوند، از طرف دیگر واکنشهایی که در آن با از بین رفتن اسید سولفوریک ، ترکیباتی تولید میشود که از نظر تجاری کم اهمیت هستند (واکنشهای پارازیتی)، یونهای مزاحمی تولید شده و باعث آلودگی مخلوط ها میشوند .
روش حرارتی(خشک)Thermal process:
این روش شامل احتراق فسفر و هیدراسیون P4O10 میباشد. مخلوط فسفر مایع و هوا به محفظه احتراق که شبیه برج است تزریق شده و با انجام واکنش اکسیداسیون فسفر، تولید میشود. جنس محفظه احتراق نوعی فولاد مخصوص است که با H3PO4 غیرفعال شده است. P4O10 به دست آمده را در برج بعدی هیدراته میکنند و بخارات باقیمانده P4O10 را ، واحد شستشو به اسید فسفریک رقیق تبدیل کرده و به عنوان افشان در پایین آوردن دمای برج اول استفاده میشود.
روش های تولید در ایران
در ايران از اثر اسيد سولفوريك بر كانيهاي آپاتيتی اسید فسفریک تولید می شود . از آنجا که فسفر وآرسنیک در یک گروه(گروه 5) جدول شیمیایی (تناوبی) قرار دارند و در طبيعت نيز به احتمال زياد در كانيهاي مختلف با هم وجود دارند و فقط در درصد خلوص انها اختلاف مي باشد.
چنانكه ميدانيد آرسنيك از عناصر سمي و كشنده به شمار مي آيد و وجود آن در كانيهاي آپاتيتي كه اسيد فسفريك از آنها تهيه ميشود و غالبا در صنايع خوراك دام و بهداشتي مصرف ميگردد خطري مهم محسوب ميگردد. البته روشهاي توليد اسيد فسفريك مثل احتراق فسفر خالص اين مشكل را حل نموده اما قيمت تمام شده بسيار بالاتر از بهره گيري از كاني هاي آپاتيتي است. فلوئور يكي ديگر ازموادي است كه سميت دارند و جزء لاينفك كاني هاي آپاتيتي است.
اسيد فسفریک
فسفریک اسید از جمله پرمصرف ترین مواد شیمیایی در صنعت است. به عنوان ماده افزودنی در نوشابه های گازدار کاربرد دارد و در تولید کودهای شیمیایی، پاک کننده های صابونی و غیر صابونی،تصفیه آب،خوراک دام و دارو سازی، مکملهای غذای دام و طیور(دی و منو کلسیم فسفات) ، مواد فسفاته شوینده ها ،تصفیه پسابها ، تولید کودهای فسفاته(مهمترین)، ضد حریق کردن برخی سطوح و عوامل بازدارنده اشتعال، ونیز جهت تمیز کردن و جرم گیری سطوح فلزی به کار می رود. فسفریک اسید خوراکی را از افزودن آب به P4O10 می سازند. اسید فسفریک اسید ضعیفی است و در شرایط عادی و مدت زمان کوتاه آنقدر نمیتواند خطرساز باشد .
کاربرد در صنایع غذایی
از اسید فسفریک در تولید غذاهای اسیدی و نوشابه های گازدار مانند انواع کولاها استفاده میشود. بکارگیری این ماده سبب دادن طعم تندی به غذا شده، و از آنجا که ماده شیمیایی با تولید انبوه است، با قیمتی ارزان و حجمی فراوان در دسترس میباشد. همانطور که ذکر شد، قیمت پایین و حجم زیاد تولید این ماده، آنرا در مقایسه با طعم دهنده های طبیعی نظیر زنجبیل برای دادن طعم تندی، یا اسید سیتریک که از لیمو (lemon) و عصاره لیموترش (lime) که برای دادن طعم ترشی بکار میرود، در رتبه بالاتری قرار داده است.
کاربرد در مواد پاک کننده
در توليد پاك كننده ها اسید فسفريك براي نرم كردن آب بكار مي رود.آب نرم بدون يونهاي كلسيم (II) و منيزيم (II) كه آب سخت را تشكيل مي دهند،اگر ازبين نروند تشكيل آب سخت را مي دهند كه اين يونها با صابون تشكيل رسوبات غير قابل حل مي دهند كه سبب لكه بروي لباس ها در هنگام شستشو مي شوند.نمكهاي فسفات از اسيد فسفريك بطور وسيع در پاك كننده هابعنوان(builder) بكار مي رود.بيشتر گستره تركيبات فسفر درمخلوط پاك كنندهاي جامد است كه سديم تري پلي فسفات يكي از آنهاست.Na5P3O10 ،بعنوان نرم كننده آب ،سديم تري پلي فسفات با كلسيم (II) و منيزيم (II) يوند برقرار مي كندو تشكيل اجزاء محلول را مي دهد كه كمپلكس يا كليت است.اين كمپلكس ها از واكنش كلسيم (II) و منيزيم (II) با صابون ممانعت بعمل مي آورندتا رسوب ايجاد نشود.
کاربرد در زدودن زنگ آهن
از اسید فسفریک میتوان مستقیماً برای زدودن زنگ آهن (اکسید آهن III) از ابزارهای آهنی یا فولادی و تبدیل آهن به فسفاتهای محلول در آب استفاده نمود. پس از زدودن زنگ آهن فسفات آهن تولید شده تبدیل به ترکیب فسفات آهن سیاه شده که خود به عنوان عامل جلوگیری از خوردگی میتواند مورد استفاده قرار گیرد. اسید فسفریک به عنوان کاتالیت در صنایع پتروشیمی کاربرد دارد.
کاربرد در پزشکی
از اسید فسفریک در دندانپزشکی و اورتودنسی بهعنوان عامل قلم زنی (Etching) جهت تمیز کردن و زبر کردن سطح دندان خصوصاً در جاهایی که از اسباب و وسایل دندانپزشکی استفاده شده، بکار میرود. همچنین از اسید فسفریک بهعنوان کاتالیست در ساخت آسپیرین بخاطر داشتن یون هیدروژن فراوان و آلایندگی کمتر در مقایسه با اسید کلریدریک و سولفوریک استفاده میشود.
کاربرد در کشاورزی
بيشتر اسيد فسفريك در توليد كود بكار مي رود.فسفر يكي از عناصر ضروري براي رشد گياهان محسوب مي شود.فسفاتهاي آلی تركيباتي هستند كه انرژي لازم براي بيشتر واكنشهايي كه در سلولهاي زنده اتفاق مي افتند را مهيا مي كنند.بنابراين خاكهاي غني با كودهاي فسفاتي رشد گياهان را بالا مي برند. افزايش غلظت فسفات در سطح آبها همچنين رشد گياهان آبزي را بالا مي برد.اضافات كودهاي شيميايي مي توانند باعث تحريك رشد گياهان در آبهاي درياچه ها و آبهاي جاري بشوند.آب فاضلاب ها كه شامل فسفات است مي تواند تاثير يكساني داشته باشد.
درياچه ها كه از مواد مغذي غني هستند از افزايش سرعت Eutrophication(انباشتگي خوراك آبي) تلف مي شوند. وقتي گياهان آبزي با اين شرايط مغزي بودن محيط رشد مي كنند پس از مدتي خواهند مرد. حال اين گياهان مرده براي تجزيه اكسیژن حل شده در آب را مصرف مي كنند. اين مصرف سطح اكسيژن حل شده را كاهش مي دهد تا نقطه اي كه براي حمايت حيوانات آبزي كافي نيست. براي كاهش تهديد Eutrophication درياچه بسياري از مناطق دارند فسفات ها را از پاك كننده ها حذف مي كنند. در بعضي از موارد فسفاتها جاي خودشان را با كربناتها عوض مي كنند. به عبارت ديگر پاك كنندهاي جديد به گونه اي تهيه مي شوند كه با كلسيم (II) و منيزيم (II) يونهاي سخت آب واكنش ندهند.
 )
)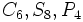 )
)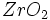 ) و اکسیدهای مختلط همچون اسپنیل (
) و اکسیدهای مختلط همچون اسپنیل (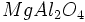 ) ، سیلیکاتهای مختلف مانند
) ، سیلیکاتهای مختلف مانند 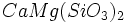 و ...
و ...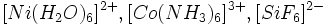 .
.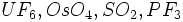 .
. .
.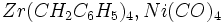 .
.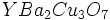 است.
است. |
|